Vaccination Contre l’Hépatite B Prévention ou Danger ?
Nour El Houda MAHDI
Le vaccin contre le virus de l’hépatite B (VHB) figure parmi les moyens de protection et de lutte contre cette maladie infectieuse majeure. Tandis que certains proclament que le vaccin a sauvé des millions de vies, d’autres pointent du doigt ses risques et questionnent son efficacité. Cet article retrace différents points concernant le virus et sa pathogénie ainsi que les controverses liées à cette vaccination.
Le VHB, agent causal
L’hépatite B est une inflammation du foie causée par le VHB, appelé particule de Dane, un membre de la famille des Hepadnaviridae. C’est un virus enveloppé possédant un génome compact à ADN circulaire partiellement bicaténaire, contenu dans une nucléocapside icosaédrique. Il se caractérise par un tropisme strict pour les hépatocytes humains,2,3 réalisant des lésions hépatiques, médiées par la réponse immunitaire,2 à type d’hépatites aiguë, fulminante ou chronique. Cette dernière expose les malades à un risque important de décès par cirrhose et carcinome hépatocellulaire, le type le plus fréquent de cancer primitif du foie.6
Bien qu’ils aient une enveloppe qui les rendent théoriquement fragiles, les virions du VHB sont très contagieux, soit 100 fois plus contagieux que le VIH, 4 et peuvent même rester infectieux plus de 7 jours à température ambiante.1
Cette résistance en milieu externe, en s’associant à la diversité des voies de transmission (parentérale, périnatale et sexuelle), fait de cette infection un problème majeur de santé publique.
Bref historique du vaccin
Les progrès scientifiques ont conduit les chercheurs à développer un vaccin, considéré comme le premier vaccin contre un cancer humain majeur et le premier contre une maladie chronique, ainsi que le premier protégeant contre une infection sexuellement transmissible.6
En 1969, Blumberg a identifié, à partir du plasma des aborigènes australiens, une isoprécipitine qu’il a appelée antigène australien, une petite protéine d’enveloppe du VHB (Ag HBs), dont la présence entraîne la sécrétion d’anticorps par l’organisme.5,10 En 1981, Hilleman et ses collègues ont réussi à faire homologuer un vaccin aux États-Unis en récoltant ce composant actif, à partir du plasma de personnes atteintes d’une infection chronique par le VHB.8 En 1986, le désir de produire des quantités illimitées en vaccin via des processus hautement contrôlés, tout en évitant la transmission des pathogènes à diffusion hématogène (VIH ou autres) via le plasma purifié, et l’avènement du génie génétique ont conduit au développement de vaccins recombinants contre l’Ag HBs. Ceux-ci sont produits à l’aide de levures modifiées génétiquement, contenant le gène S, le segment de l’ADN du virus responsable de la synthèse de l’antigène de surface.8 En 1991, l’Organisation Mondiale de la Santé (OMS) a approuvé le fait que tous les pays devraient intégrer la vaccination contre le VHB dans leurs programmes nationaux de vaccination. En 2000, la vaccination contre l’hépatite B a été introduite en Algérie.
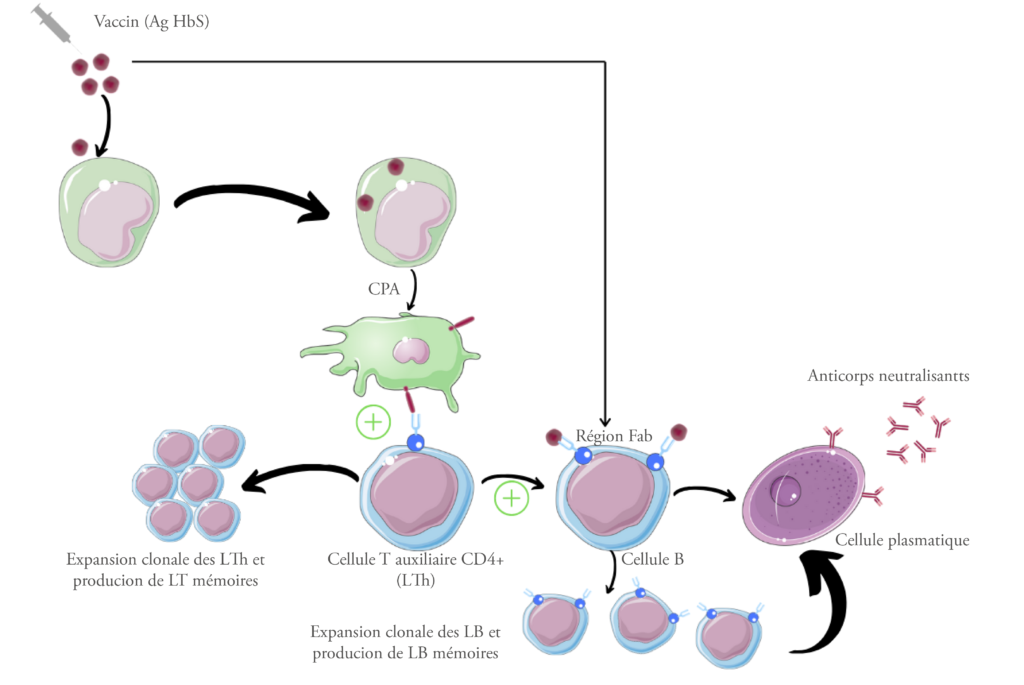
Mécanisme d’action du vaccin
Les protéines (Ag Hbs) contenues dans le vaccin sont internalisées dès leur (introduction) dans l’organisme par les cellules présentatrices d’antigène (CPA), qui les présentent à leur surface aux cellules T auxiliaires (LTh), entrainant une expansion clonale de ces dernières ainsi que la production de cellules T mémoires. Les cellule B, secondairement à une signalisation par les cytokines via les cellules T auxiliaires, subissent une hyper mutation somatique au niveau de la région Fab, ce qui augmente encore l’affinité de l’antigène à l’anticorps ultérieurement produit. Les cellules B se transforment en cellules plasmatiques productrices d’anticorps neutralisants. Ils subissent également une expansion clonale et une formation de cellules mémoires intervenant dans la réponse immunitaire secondaire contre les réinfections par le même pathogène.
Aussi, il peut arriver que l’antigène soit reconnu directement par les cellules B, produisant une réponse immunitaire faible (cf article du Dr R. Fellah – Immunity Behind Immunization – Medpress n°2 septembre 2019).29
Toutefois, ces vaccins recombinants contiennent moins de composants antigéniques, ce qui risque de diminuer la formation d’une mémoire immunologique, d’où l’utilisation d’adjuvants tels que les sels d’aluminium. Ces derniers peuvent former des particules insolubles et provoquer la rétention et la libération progressive des antigènes comme un dépôt.10
Les origines de la controverse
Un lien de causalité avec la sclérose en plaque
En France, au mois de juillet 1994, une vaste campagne de vaccination contre le virus de l’hépatite B a été lancée par le ministère de la Santé ciblant les nouveau-nés, les enfants en première année secondaire et les adultes à haut risque. Deux ans plus tard, en 1996, un scepticisme à l’égard de l’innocuité du vaccin a alimenté des controverses telles que la suspicion d’un lien entre la vaccination contre l’hépatite B et la sclérose en plaque. En effet, 249 cas de désordres démyélinisants centraux chez des adultes, principalement des scléroses en plaques, identifiés après l’injection de vaccin anti-HB, ont été signalés à l’Agence Française des Médicaments. En conséquence, une véritable polémique rapidement médiatisée a pris naissance, ce qui a engendré des incertitudes parmi les professionnels de la santé et des peurs chez de nombreux parents. Ensuite, la décision, 4 ans plus tard, en 1998, de ce même ministère de suspendre la campagne de vaccination des adultes, par « principe de précaution », avait probablement renforcé la suspicion. Au fil des années, le nombre de déclarations a augmenté, atteignant au total 624 cas déclarés au centre de la pharmacovigilance français en 2000.7
Face à ce véritable problème de santé publique, plusieurs études épidémiologiques ont été réalisées afin d’évaluer l’association présumée. La plupart de ces publications ont signalé l’absence de lien ou un risque légèrement accru, mais pas suffisamment significatif d’un point de vue statistique.7,28 Parmi ces études, on en cite les suivantes :16-24.
Cependant, certaines études ont conclu l’existence de ce lien, notamment l’étude d’Hernan de la revue Neurology publiée en 2004.13 Les experts de l’OMS et de la commission de pharmacovigilance en France ont évoqué les nombreux biais de cette étude dans des communiqués publiés dans la même année. Les principales critiques concernent le nombre insuffisant de patients vaccinés atteints de SEP, une fenêtre de temps très large (trois ans), de plus l’échantillon n’était pas représentatif de la population générale mais orienté exclusivement vers des individus à risque élevé. Aussi, la suggestion des auteurs que l’association entre SEP et vaccination contre l’hépatite B pourrait être expliquée par l’utilisation d’adjuvants tels que l’aluminium ou le thiomersal, est considérée comme infondée puisque aucune association n’a été mise en évidence pour d’autres vaccinations (grippe et tétanos) utilisant les mêmes adjuvants.14-15
Pourquoi cette singularité française ?
Quelques hypothèses ont été proposées afin d’expliquer la survenance de cette augmentation uniquement en France et pas dans d’autres pays :
– La compagne de vaccination de 1994 a dépassé son objectif et a touché plus de 20 millions d’adultes : une tranche d’âge connue pour être à risque de SEP ; alors qu’elle n’a jamais atteint 30% chez les nouveau-nés considérés comme la population cible.7
– L’élévation de l’incidence de la SEP vers les années 1996 est probablement liée d’une part au développement et à l’accessibilité des outils diagnostics dans les hôpitaux français tels que l’IRM, d’autre part, la déclaration de la maladie est devenue massive du fait de la disponibilité du traitement immunomodulateur à base d’interféron et de son remboursement total par la sécurité sociale.11-13
Pour conclure, l’analyse de ces données n’a pas permis de démontrer un lien autre que la coïncidence entre l’exposition au vaccin et la sclérose en plaques.
Un lien avec d’autres maladies
A ce jour, il n’existe pas d’arguments en faveur de l’existence d’une association avec la vaccination contre le VHB et la polyarthrite rhumatoïde, le syndrome de Guillain-Barré, les maladies thyroïdiennes auto-immunes, l’asthme, le diabète sucré ni le syndrome de fatigue chronique.2,9,25
La vaccination des nouveaux nés
La plupart des parents anti-vaccination s’opposent à la vaccination de leurs nouveau-nés contre les maladies peu fréquentes dans cette tranche d’âge à l’instar de l’hépatite B. Or, plus la personne infectée est jeune plus grand est le risque de survenue d’hépatite chronique par défaut de clearance immunitaire du virus ou par retard diagnostic du fait de la pauvreté du tableau clinique à cet âge.4 En outre, la justification de l’introduction de la vaccination aux nourrissons repose sur l’efficacité maximale du vaccin à cette période de la vie, sur la longue durée de protection apportée, et enfin sur la facilité d’intégration de cette vaccination dans le calendrier vaccinal.13
L’innocuité du vaccin
Le vaccin contre le VHB a peu d’effets indésirables. Les plus courants sont mineurs et transitoires, tels que des douleurs au site d’injection, une fatigue, une fièvre légère, des céphalées. Cependant une hypersensibilité à la levure ou à l’un des composants du vaccin est une contre-indication absolue pour la vaccination car elles sont pourvoyeuses d’une réaction allergique potentiellement mortelle,4-10 dont l’incidence est estimée à 1,1 cas par million de doses de vaccin.2
L’efficacité du vaccin
Le programme de vaccination contre l’hépatite B est très efficace, comme en témoigne les études menées dans de nombreux pays de forte endémie qui ont montré une différence notable de prévalence des porteurs de l’antigène HBs avant et après vaccination.26,27 « A Taïwan on note une réduction spectaculaire de 10 % de l’incidence en quelques années ».12 Selon l’OMS, la série vaccinale complète induit la constitution de titres d’anticorps protecteurs chez plus de 95% des nourrissons, des enfants et des jeunes adultes. Cette protection dure au moins 20 ans et probablement toute la vie.
Conclusion
Selon les données disponibles à nos jours, la balance entre le bénéfice de la vaccination contre le virus de l’hépatite B et le risque hypothétique de favoriser des maladies graves, semble pencher fortement en faveur de la vaccination qui a prouvé son efficacité et son innocuité.
Références
- Louten J. Essential Human virology. Elsevier; 2016. Chapter 12 : Hepatitis Viruses ; pp 213-233.
- World Health Organization. Hepatitis B vaccines: WHO position paper, July 2017– Recommendations.WklyEpidemiol Rec. 2017;92(27):369–92
- Ryu W-S. Molecular Virology of Human Pathogenic Viruses. Elsevier; 2017. Chapter 18 : Hepadnaviruses ; pp 247-260.
- Davidson, T. The vaccine debate. Denver, Colorado: Greenwood; 2019. Chapter 5: Vaccines and the Diseases They Prevent; pp.69-123.
- Van Damme P, Ward JW, Shouval D, Zanetti A. Hepatitis B Vaccines. In: PlotkinSA, OrensteinWA, OffitPA, EdwardsKM. Plotkin’s Vaccines. 7th Edition. Philadelphia, PA : Elsevier, 2018. pp342-374.
- Chang M, Chen D. Prevention of Hepatitis B. Cold Spring Harbor Perspectives in Medicine. 2015;5(3):a021493-a021493.
- Mouchet J, Bégaud B. Hepatitis B vaccination and central demyelination – History, description and observed/expected analyses of 624 cases reported to the French pharmacovigilance over a 20-year period. Vaccine. 2019;37(15):2142-2148.
- Leroux-Roels G. Old and new adjuvants for hepatitis B vaccines. Medical Microbiology and Immunology. 2014;204(1):69-78.
- Duclos P. Safety of immunisation and adverse events following vaccination against hepatitis B. Expert Opinion on Drug Safety. 2003;2(3):225-231.
0- Das S, Ramakrishnan K, Behera S, Ganesapandian M, Xavier A, Selvarajan S. Hepatitis B Vaccine and Immunoglobulin: Key Concepts. Journal of Clinical and Translational Hepatology. 2019;7(X):1-7.
1- Debouverie M, Pittion-Vouyovitch S, Louis S, Roederer T, Guillemin F. Increasing incidence of multiple sclerosis among women in Lorraine, Eastern France. Multiple Sclerosis Journal. 2007;13(8):962-967.
2- Degos F. Vaccination contre le VHB : les experts de l’INSERM et de l’ANAES prennent position. Gastroentérologie Clinique et Biologique. 2004;28(1):50-53.
3- Hernan M, Jick S, Olek M, Jick H. Recombinant hepatitis B vaccine and the risk of multiple sclerosis: A prospective study. Neurology. 2004;63(5):838-842.
4- Organisation Mondiale de la Santé. Comité consultatif mondial sur la sécurité des vaccins de l’Organisation mondiale de la Santé: réponse à l’article de Hernán et al. intitulé «Vaccin Hépatite B recombinant et risque de sclérose en plaques» et publié le 14 septembre 2004 dans la revue Neurology [Internet]. Who.int. 2019 [cited 22 August 2019]. Available from: https://www.who.int/vaccine_safety/committee/topics/hepatitisb/multiple_sclerosis/sep_04/fr/.
5- afssaps. Vaccins contre l’hépatite B : résumé des débats de la commission nationale de pharmacovigilance du 21 septembre 2004. p. 1-4.
6- Zipp F, Weil J, Einhäupl K. No increase in demyelinating diseases after hepatitis B vaccination. Nature Medicine. 1999;5(9):964-965.
7- Sadovnick A, Scheifele D. School-based hepatitis B vaccination programme and adolescent multiple sclerosis. The Lancet. 2000;355(9203):549-550.
8- Ascherio A, Zhang S, Hernán M, Olek M, Coplan P, Brodovicz K et al. Hepatitis B Vaccination and the Risk of Multiple Sclerosis. New England Journal of Medicine. 2001;344(5):327-332.
9- Confavreux C, Suissa S, Saddier P, Bourdès V, Vukusic S. Vaccinations and the Risk of Relapse in Multiple Sclerosis. New England Journal of Medicine. 2001;344(5):319-326.
0- Touzé E, Fourrier A, Rue-Fenouche C, Rondé-Oustau V, Jeantaud I, Bégaud B et al. Hepatitis B Vaccination and First Central Nervous System Demyelinating Event: A Case-Control Study. Neuroepidemiology. 2002;21(4):180-186.
1- DeStefano F. Vaccinations and Risk of Central Nervous System Demyelinating Diseases in Adults. Archives of Neurology. 2003;60(4):504.
2- Mikaeloff Y. Hepatitis B Vaccination and the Risk of Childhood-Onset Multiple Sclerosis. Archives of Pediatrics & Adolescent Medicine. 2007;161(12):1176.
3- Ramagopalan S, Valdar W, Dyment D, DeLuca G, Yee I, Giovannoni G et al. Association of InfectiousMononucleosiswith Multiple Sclerosis. Neuroepidemiology. 2009;32(4):257-262.
4- Langer-Gould A, Qian L, Tartof S, Brara S, Jacobsen S, Beaber B et al. Vaccines and the Risk of Multiple Sclerosis and Other Central Nervous System Demyelinating Diseases. JAMA Neurology. 2014;71(12):1506-13.doi:JAMA Neurol. 2014;71(12):1506-1513.
5- Yu O, Bohlke K, Hanson C, Delaney K, Rees T, Zavitkovsky A et al. Hepatitis B vaccine and risk of autoimmune thyroid disease: a Vaccine Safety Datalink study. Pharmacoepidemiology and Drug Safety. 2007;16(7):736-745.
6- Chiang CJ et al. Thirty-year outcomes of the National Hepatitis B Immunization Program in Taiwan. J Am Med Assoc. 2013;310:974–976.
7- Goldstein S, Zhou F, Hadler S, Bell B, Mast E, Margolis H. A mathematical model to estimate global hepatitis B disease burden and vaccination impact. International Journal of Epidemiology. 2005;34(6):1329-1339.
9- Article du Dr R. Fellah – Immunity Behind Immunization – Medpress n°2 septembre 2019.