Tolérance et Hyperalgésie Induite par les Opioïdes
Khadidja AYADI
Les opioïdes sont les médicaments les plus puissants utilisés pour contrôler les douleurs aiguës et chroniques. En agissant sur leur système analgésique endogène, ces médicaments génèrent des mécanismes d’inhibition des vois ascendantes de la transmission de la douleur parallèlement à l’activation des voies descendantes analgésiques pour réprimer cette dernière. Cependant, une neuroadaptation empêche les opioïdes de fournir un effet analgésique à long terme et produit des effets opposés. Cette neuro-adaptation à l’utilisation répétée des opioïdes se traduit par le développement de deux phénomènes consécutifs et interdépendants : la tolérance et l’hyperalgésie induite par les opioïdes (opioid induced hyperalgesia – OIH). La tolérance, un concept pharmacologique, et l’OIH, un syndrome clinique, ont été principalement observés dans des conditions expérimentales chez des animaux et des volontaires humains impliquant les voies de signalisation des récepteurs opioïdes. En revanche, leur apparition et leur accord dans la pratique clinique restent débattues. Les stratégies éventuelles pour limiter ou prévenir la tolérance aux opioïdes et l’OIH sont L’épargne ou La rotation des opioïdes. Des recherches en cours visent à développer des stratégies pour une meilleure gestion de la douleur dont l’augmentation des actions endogènes des opioïdes et l’activation sélective des récepteurs opioïdes périphériques demeurent les plus prometteuses.
Introduction
La douleur chronique est un problème majeur de la santé publique qui diminue la qualité de vie des patients. Malgré le développement de nouvelles substances analgésiques pour traiter la douleur, les opioïdes restent la classe d’analgésiques la plus puissantes ; de palier trois selon la classification de l’OMS;9 utilisée pour des douleurs aiguës et chroniques, où un traitement à long terme peut se révéler nécessaire.1 Toutefois, cette utilisation à long terme est non seulement associée à des effets indésirables, mais aussi, accompagnée par des troubles cliniques correspondant, dans leur majorité, au phénomène de la tolérance suivie par un développement probable d’une hyperalgésie, ce qui représente le cœur d’un débat continu entre défenseurs et opposants de la prescription des opioïdes aux patients douloureux chroniques.10
La douleur physiologique et pathologique
La douleur physiologique est un signe d’alerte précoce essentiel qui provoque généralement un réflexe de retrait et favorise ainsi la survie de l’organisme en le protégeant contre une nouvelle lésion tissulaire. En revanche, la douleur pathologique (ou chronique) résulte d’un fonctionnement inadapté du système nerveux ; il s’agit d’une douleur en tant que maladie impliquant des interactions bio-psycho-sociales complexes nuisant à la qualité de vie du patient.24,13 La douleur chronique, définie comme une douleur qui dure plus de trois mois, touche environ 55 % de la population de plus de 20 ans et comprend les maux de tête débilitants, les douleurs articulaires, les douleurs dorsales graves et les douleurs liées au cancer. En effet, plus de 90 % des personnes souffrant des douleurs chroniques reçoivent des thérapies aux opioïdes, la morphine étant l’un des médicaments les plus couramment prescrits.24
La douleur physiologique est transmise par un système sensoriel composé de neurones sensitifs primaires, d’interneurones spinaux, de voies ascendantes et de zones supraspinales. Les ganglions trigéminal et spinal donnent naissance à des fibres Ad et C (nocicepteurs) à seuil élevé qui innervent les tissus périphériques (peau, muscles, articulations, viscères). Lorsque le tissu périphérique est endommagé, les nocicepteurs sont sensibilisés et/ou activés par des stimulus thermiques, mécaniques et/ou chimiques produisant ainsi des potentiels d’action consécutifs qui sont ensuite conduits le long de l’axone sensoriel jusqu’à la corne dorsale de la moelle épinière.7,12,6
Par la suite, ces impulsions sont transmises aux neurones spinaux ascendants, au tronc cérébral, au thalamus et au cortex. La stimulation répétée des nocicepteurs peut sensibiliser à la fois les neurones périphériques et les neurones centraux. Elle peut être soutenue par des changements dans l’expression des gènes codant pour les neuropeptides, les canaux ioniques, les récepteurs et les molécules de signalisation dans les neurones périphériques et centraux.6
Parallèlement à ces événements excitateurs, de puissants mécanismes endogènes contre la douleur se développent, parmi lesquels le système opioïde endogène joue le rôle principal.6
Le système opioïde endogène
Il est l’un des systèmes innés de soulagement de la douleur les plus étudiés.12 Ce système est constitué de neurones largement dispersés qui produisent 4 types de molécules opioïdes : la b-endorphine, les met- et leu-enképhalines et les dynorphines. Ces opioïdes agissent comme des neurotransmetteurs et des neuromodulateurs au niveau de trois grandes classes de récepteurs ; appelées m, d et k ; produisant une analgésie.12,5
Ces récepteurs sont largement distribués dans la moelle épinière et des structures cérébrales, notamment la substance grise périaqueducale (PAG), le locus coeruleus et la moelle épinière dorsale et ventrale.2,5 Les trois récepteurs opioïdes sont des protéines à sept domaines transmembranaires couplés à la protéine G inhibitrice (Gi). Après activation par un agoniste endogène, tel que l’endorphine, les sous-unités Gai et Gbd de la protéine Gi se dissocient l’une de l’autre et agissent ensuite sur diverses voies intracellulaires.4 Les actions les plus fréquemment signalées comprennent l’inhibition de l’adénylyl cyclase (AC), l’activation de la conductance du potassium et l’inhibition de la conductance du calcium.15
L’aspect classique et peut-être le plus important de la transduction du signal des récepteurs opioïdes concerne leur capacité à moduler les canaux ioniques de calcium et de potassium. Au niveau de la moelle épinière et par leur action présynaptique, les opioïdes inhibent l’influx de Ca2+ et la libération ultérieure de glutamate et de neuropeptides (par exemple, la substance P, le peptide lié au gène de la calcitonine) à partir des terminaisons afférentes primaires.4,5,6 Postsynaptiquement, les opioïdes hyperpolarisent les neurones de projection ascendante en augmentant la conductance du K+ inhibant ainsi la transmission du signale et, par conséquent, ils répriment la douleur. 25,5
En outre, plusieurs études ont démontré un effet analgésique important des opioïdes au niveau du système nerveux central.8 Au sein de la substance grise périaqueducale PAG et en se liant à leurs récepteurs, Les opioïdes activent les systèmes analgésiques par un mécanisme de désinhibition, ce qui signifie une réduction de l’inhibition des interneurones GABAergiques par deux processus majeurs : l’inhibition postsynaptique directe des interneurones GABAergiques, et l’inhibition présynaptique de la probabilité de libération du GABA à partir des terminaisons nerveuses.
Ensemble, cette désinhibition pré et postsynaptique conduit à l’activation de la voie analgésique descendante du PAG qui se projette via la moelle allongée jusqu’à la corne dorsale dans la moelle épinière.13
Les opioïdes exogènes
Le terme ”analgésiques opioïdes” désigne une large classe de médicaments comprenant les alcaloïdes extraits des graines de pavot (morphine, codéine) et leurs dérivés semi-synthétiques (oxycodone, hydromorphone, oxymorphone), les phénylpipéridines synthétiques (mépéridine, fentanyl) ainsi que les pseudo pipéridines synthétiques telles que la méthadone.16
Comme leurs homologues endogènes, ces médicaments opioïdes agissent sur les mêmes récepteurs pour produire un effet analgésique nettement plus important que le placebo, soit une réduction d’environ 30 % de la douleur déclarée, quel que soit le type de douleur et/ou le type d’opioïde prescrit.17 L’utilité clinique des opioïdes continue d’être limitée par un compromis entre efficacité et effets secondaires. Les effets secondaires les plus courants des opioïdes peuvent être divisés en effets périphériques (constipation, rétention urinaire, urticaire, bronchospasme) et en effets centraux (nausées, sédation, dépression respiratoire, hypotension, myosis, suppression de la toux), qui tous affectent sérieusement la qualité de vie du patient et leur utilité clinique entraînant un arrêt précoce, un sous-dosage du traitement et par conséquent une analgésie inadéquate.2,14
Parallèlement aux effets secondaires, le développement d’une tolérance aux analgésiques opioïdes est l’obstacle majeur à la thérapie clinique des opioïdes.16
La tolérance
La tolérance est un état d’adaptation, dans lequel l’exposition à un médicament induit des changements qui se traduisent par une diminution d’un ou plusieurs effets du médicament, où une dose plus élevée est nécessaire au fil du temps pour maintenir le même niveau d’efficacité. 18
La tolérance aux opioïdes est l’une des complications courantes du traitement aux opioïdes. Elle est définie par la FDA (Food and Drug Administration) comme une consommation de 60 mg d’équivalent morphine par jour19, entraînant ainsi une diminution de l’efficacité analgésique et une augmentation constante des doses prescrites.14 La durée moyenne de la consommation d’opioïdes pour le traitement de la douleur chronique est de 105 jours, pendant lesquels les doses peuvent augmenter jusqu’à 10 fois la dose initiale selon certaines études.11,20 Cette augmentation progressive des doses peut, en revanche, aggraver le problème perpétuel des effets secondaires du traitement aux opioïdes.4
Mécanismes de la tolérance
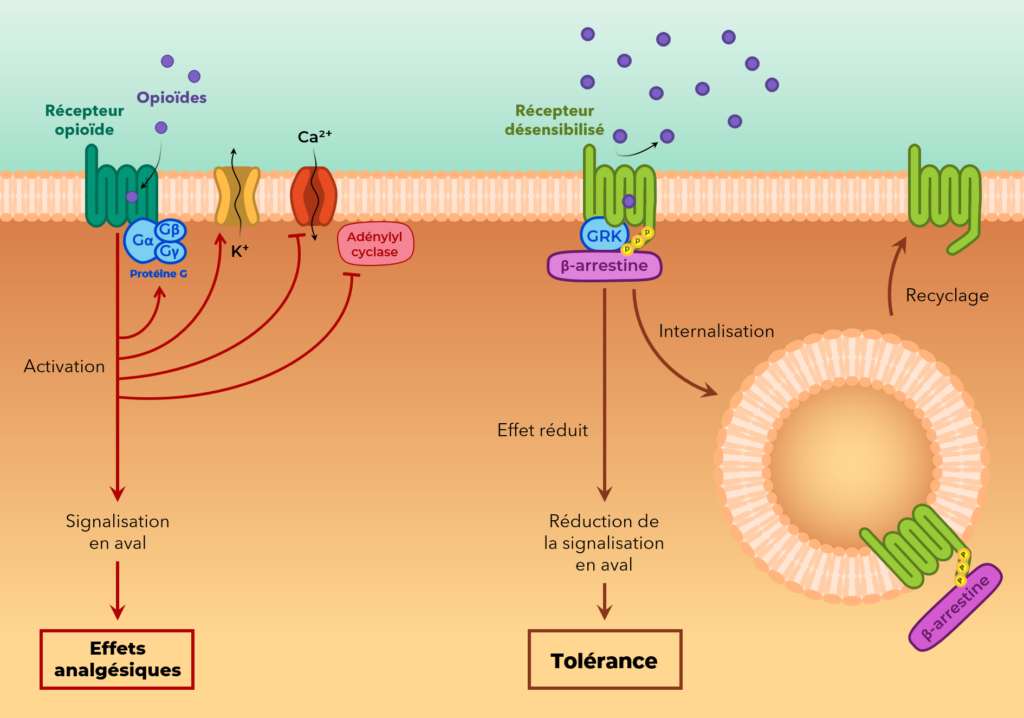
Les mécanismes qui sous-tendent le développement de la tolérance aux opioïdes restent encore incertains. Dans les modèles cellulaires, l’exposition chronique aux agonistes opioïdes entraîne plusieurs changements adaptatifs tels que la régulation négative des récepteurs opioïdes, l’internalisation et le découplage des protéines Gi. Ces processus se traduisent par une désensibilisation des récepteurs opioïdes.
Désensibilisation
Le phénomène de désensibilisation est défini par une perte progressive de la fonction des récepteurs en cas d’exposition continue à un agoniste.3 Diverses protéines kinases peuvent phosphoryler les régions intracellulaires des récepteurs opioïdes favorisant ainsi la liaison des protéines arrestines. Cela conduit à une désensibilisation des récepteurs en empêchant le couplage des protéines Gi, et à l’internalisation des récepteurs par des voies dépendantes de la clathrine.6 Le recyclage des récepteurs opioïdes déphosphorylés et leur réintégration dans la membrane plasmique, après une internalisation préalable, rétablit la transduction du signal, tandis que le ciblage alternatif aux lysosomes entraîne une dégradation des récepteurs correspondant à une régulation négative de ces derniers.4,3
La désensibilisation des 3 types des récepteurs opioïdes a été observée dans plusieurs études in vitro. Néanmoins, la relation entre la désensibilisation des récepteurs et le développement de la tolérance aux opioïdes restent controversée.3
La régulation négative
Elle est caractérisée par une perte généralisée des récepteurs intracellulaires et de surface, ce qui peut expliquer la perte de réactivité des récepteurs opioïdes.3 La régulation négative des récepteurs après une exposition chronique aux opioïdes a clairement été démontrée in vitro, bien que les résultats des études in vivo soient très variables.3 La prise chronique de la morphine ne montre généralement pas de régulation négative des récepteurs opioïdes in vivo (une régulation positive des récepteurs opioïdes se produit à sa place), cependant, elle entraîne une tolérance significative chez les animaux et les humains ce qui suggère une faible relation de cause entre la tolérance et la régulation négative.4,3
L’internalisation
Contrairement au processus de régulation négative des récepteurs, l’internalisation n’est pas associée à la dégradation des complexes ligand-récepteur dans les lysosomes, de sorte qu’elle se produit sans diminution de la densité des récepteurs dans la cellule.3 Il a été estimé que l’internalisation du récepteur par la voie endocytaire induite par les agonistes contribue directement à la tolérance en diminuant le nombre des récepteurs opioïdes à la surface des cellules. Cependant, des études plus récentes ont montré que la morphine ne favorise pas l’endocytose des récepteurs opioïdes in vivo, bien qu’elle soit très efficace pour induire la tolérance in vitro. En outre, il a été démontré que l’endocytose et le recyclage du récepteur opioïde diminuent considérablement la tolérance aux opioïdes. Ces résultats suggèrent que l’internalisation du récepteur pourrait être un mécanisme de protection plutôt qu’un mécanisme de déclanchement de la tolérance.4,5
Une autre réponse adaptative à une exposition prolongée aux opioïdes correspond à une régulation positive ou une super-sensibilisation du système de transduction du signal adénosine monophosphate cyclique (AMPc). 3,4
La super-sensibilisation d’AC
Les opioïdes diminuent nettement la stimulation des neurones par l’inhibition de l’AC et d’autres effets inhibiteurs additifs. Néanmoins, en cas d’exposition continue aux opioïdes, le taux de stimulation des neurones se retourne aux niveaux de prétraitement en raison d’une augmentation compensatoire de l’activité d’AC et de la production d’AMPc.3 Pour expliquer ces mécanismes de compensation, des études récentes suggèrent une augmentation des niveaux d’AMPc cellulaire suite à une stimulation directe de l’activité d’AC. Il s’est avéré que l’activation de la protéine Gi libère des sous-unités G-bêta-gamma (inhibitrices de l’AC), mais aussi, elle peut stimuler l’AC en provoquant parallèlement l’activité des protéines G stimulatrices (Gs). Outre qu’une accentuation de la phosphorylation des isoformes AC, ces mécanismes conduisent à la super-sensibilisation d’AC en repense à une activation répétée des récepteurs opioïdes.3
D’autres études suggèrent que l’accumulation d’AMPc pourrait être due à la capacité du récepteur opioïde à stimuler l’AC directement par l’intermédiaire des protéines Gs. Les récepteurs opioïdes semblent se coupler aux protéines Gs et Gi, et des effets inhibiteurs et stimulants à double sens, médiés par les protéines Gs et Gi, ont été démontrés pour la plupart des opioïdes, à l’exception de l’étorphine et de la dihydroétorphine. En effet, le traitement chronique aux opioïdes modifie l’équilibre entre les récepteurs opioïdes couplés aux protéines Gi et Gs, dont les effets stimulants deviennent plus prononcés dans les quelques jours suivant l’exposition aux opioïdes.3
Ce mécanisme de compensation par la super-sensibilisation d’AC rétablit l’état d’excitation neuronal aux niveaux de prétraitement. C‘est là que se développe la tolérance aux opioïdes. Ceci se manifeste lors de l’arrêt brutal du traitement aux opioïdes ou de l’administration d’antagonistes : une surexcitation des neurones plusieurs fois supérieure aux niveaux de prétraitement s’installe, laissant ainsi la voie AMPc régulée positivement sans concurrence.3
Reproduction de Islem BAGHDALI
Les médiateurs inflammatoires dans la tolérance aux opioïdes
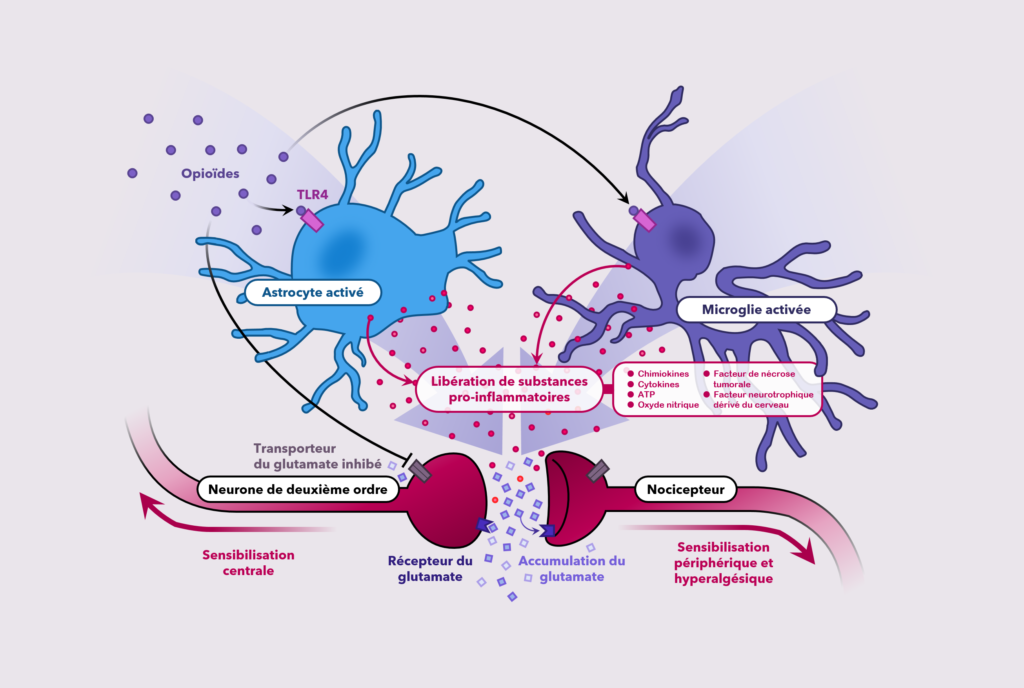
Une littérature de plus en plus croissante indique que les opioïdes ; essentiellement la morphine ; sont des activateurs des astrocytes et des microglies dans le système nerveux central. Dans la moelle épinière, la morphine et d’autres opioïdes induisent la libération des cytokines pro-inflammatoires dérivées des cellules gliales. Il a été démontré que les cytokines pro-inflammatoires diminuent l’expression des récepteurs GABA, augmentent le nombre et la conductance des récepteurs AMPA (alpha -amino-3-hydroxy-5-méthylisoazol-4-propionate) et NMDA (N-méthyl-D-aspartate) ( ce sont des récepteurs ionotropes postsynaptiques sensibles au glutamate), diminuent les protéines de transport du glutamate et diminuent, également, les courants de potassium sortants, entraînant une augmentation globale de la neuro-excitabilité qui s’oppose aux actions analgésiques de la morphine et induit une tolérance.11
De récentes études in vivo et in vitro démontrent que ces effets pro-inflammatoires de certains opioïdes sont médiés par le récepteur immunitaire inné (Toll-like receptor 4-TLR4). Le TLR4 se trouve sur les microglies et, à un moindre degré, sur les astrocytes, mais pas sur les neurones.11 Les opioïdes, dont la morphine, se lient au TLR4 et déclenchent une réponse inflammatoire entraînant une libération importante des cytokines pro-inflammatoires des cellules gliales dont les interleukines bêta1 et 6 (l’IL-1b, l’IL-6) et le facteur de nécrose tumorale (Tumor necrosis factor-TNF), des chimiokines, de l’ATP, des acides aminés excitateurs et des radicaux libres neuroexcitotoxiques (exemple : Oxide Nitrique ou NO).11 L’IL-1b et le TNF se lient à leurs récepteurs cibles sur les astrocytes et les microglies, ce qui entraîne une libération supplémentaire des facteurs pro-inflammatoires (par exemple IL-1b, IL-6, TNF, ATP, oxyde nitrique synthase (NOS) et facteur neurotrophique dérivé du cerveau ou BDNF : Brain Derived Neurotrophic Factor). En effet, l’IL-1b augmente le glutamate extracellulaire par régulation négative du transporteur de glutamate (Glutamate transporter 1-GLT-1).11 Elle phosphoryle également le récepteur NMDA, entraînant une augmentation de l’ouverture de ses canaux ioniques, permettant, ainsi, un afflux du calcium qui provoque une augmentation de l’oxyde nitrique et de la prostaglandine E2 (PGE2).21
Ensemble, ces actions extra et intra cellulaires amplifient l’excitabilité des neurones de projection de la douleur et répriment, donc, l’effet analgésique des opioïdes.
Un ensemble de travaux sur la moelle épinière, a récemment démontré que la tolérance chronique provoquée par la morphine augmentait significativement l’ARNm du TLR4 dans la PAG ventrolatérale et augmentait l’expression des cytokines pro-inflammatoires (IL-1b, TNF, et IL-6) et leur processus de signalisation ultérieur. Ensemble, ces données indiquent que l’activation gliale induite par la morphine entraîne la libération d’un nombre important de facteurs qui créent un environnement «hyper-excitateur» contribuant à la tolérance à cette dernière.11
L’utilisation à long terme des opioïdes entraîne une tolérance accrue aux opioïdes, qui se caractérise par une augmentation des doses nécessaires pour maintenir l’analgésie, ce qui contribue ensuite au développement d’une hyperalgésie induite par les opioïdes.22
Reproduction de Islem BAGHDALI
L’hyperalgésie induite par les opioïdes (OIH)
Elle est définie par un développement d’une hypersensibilité aux stimulus qui sont normalement douloureux.21 L’OIH est généralement diagnostiquée erronément comme une douleur s’aggravant avec la progression de la maladie sous-jacente, en revanche, elle ne peut pas être résolue en augmentant la dose du médicament, ce qui peut, au contraire, aggraver la douleur et c’est ainsi qu’elle ne peut être soulagé qu’en diminuant la dose d’opioïde ou en l’arrêtant, tout en utilisant d’autres stratégies pour traiter le fond douloureux préexistant.19,1 Cette éventualité clinique est assez complexe, car une boucle de rétroaction négative peut être générée, de sorte que le développement de la tolérance incite souvent les médecins à augmenter les doses des opioïdes et cette décision, à son tour, facilite le développement de l’OIH.1
Comme la tolérance, la pathogenèse exacte de l’hyperalgésie reste inconnue, cependant, plusieurs mécanismes ont été suggérés, notamment l’activation glutaminergique, la signalisation intracellulaire altérée des récepteurs opioïdes impliquant le couplage aux protéines Gs, le rôle des récepteurs de la substance P, de la neurokinine 1 (NK-I) et de la dynorphine spinale et, enfin, une accumulation des preuves impliquant la signalisation des récepteurs Toll-like (TLR) aussi que les cellules gliales.21*
Le mécanisme le plus étudié et peut être le plus probable est la sensibilisation du système glutaminergique impliquant l’activation des récepteurs NMDA associés au glutamate, l’inhibition de la recapture du glutamate et la protéine kinase C (PKC) intracellulaire régulée par le calcium.21 L’hypothèse de Zhao et al., est que l’administration chronique des opioïdes peut induire une translocation de PKC vers la membrane plasmique conduisant à l’activation du récepteur NMDA présynaptique par élimination du Mg2+ qui bloque le récepteur. Cela a pour conséquence de favoriser le déplacement du récepteur NMDA vers la membrane plasmique afin d’augmenter son activité, ce qui se traduit par une libération plus importante de glutamate. Associés à une inhibition du système de transport du glutamate, ces mécanismes provoquent une augmentation du niveau de la glutamate dans la fente synaptique, et donc une surstimulation des synapses qui pourrait conduire à une hyperalgésie.23
Outre que l’hyperalgésie, des problèmes particuliers peuvent se manifestés après une consommation importante et à long terme des opioïdes. En effet, certains patients deviennent psychologiquement dépendants du médicament, tandis que d’autres peuvent présenter des signes d’altération des performances psychomotrices. De surcroît, il a été prouvé que les opioïdes à forte dose peuvent être relativement dangereux, entraînant un risque accru d’une dépression respiratoire, et des troubles respiratoires du sommeil, avec une efficacité limitée à long terme.16
Les stratégies thérapeutiques
Certaines stratégies, telles que l’utilisation des thérapies d’épargne des opioïdes et la rotation des opioïdes, sont actuellement utilisées pour prévenir et traiter la tolérance et l’hyperalgésie, bien que les preuves à l’appui de ces méthodes soient insuffisantes.2
L’épargne des opioïdes :
L’une des méthodes les plus couramment utilisées pour prévenir la tolérance aux opioïdes et l’hyperalgésie est le traitement adjuvant comme les anticonvulsivants et les antidépresseurs, ainsi que les thérapies non médicamenteuses comme la chaleur, le froid et des programmes d’exercice. Cette approche d’épargne des opioïdes vise à réduire au minimum les doses d’opioïdes tout en assurant un soulagement optimal de la douleur. Malgré les preuves qui remettent en cause ce principe, de nombreux spécialistes de la douleur acceptent l’idée qu’un plan de traitement d’épargne des opioïdes est la première étape pour réduire de manière proactive les effets secondaires et la tolérance aux opioïdes.2
La rotation des opioïdes :
La plupart des opioïdes utilisés dans la pratique clinique sont principalement des µ-agonistes. Il existe au moins sept sous-types de récepteurs µ et chaque opioïde peut avoir des affinités différentes pour les divers sous-types où une tolérance croisée incomplète peut se développer séparément à chaque sous-type en réponse à un opioïde particulier.2 De ce fait, lorsqu’un patient passe d’un opioïde à un autre, ce dernier peut avoir une sélectivité différente pour les différents sous-types de récepteurs µ, ce qui explique le phénomène de la tolérance croisée «incomplète» offrant un moyen de surmonter la tolérance par la rotation des opioïdes. Plusieurs rapports ont documenté le succès de cette stratégie, néanmoins, le niveau de preuve n’est pas assez fort pour trancher sur la véracité de ces résultats.2
D’autres techniques thérapeutiques, telles que l’utilisation des thérapies associant des opioïdes et leurs antagonistes à faibles doses pour empêcher la commutation de la protéine G, l’inhibition de l’arrestine 2 pour empêcher la régulation négative ou l’utilisation des antagonistes des récepteurs CCK et NMDA pour bloquer les voies de facilitation de la douleur, sont encore au stade d’études précliniques.2,5
Bien que La FDA a approuvé des médicaments non opiacés pour le traitement des DCNC (douleurs chroniques non cancéreuses) ; tels que les inhibiteurs de la cyclo-oxygénase (ibuprofène, célécoxib), les inhibiteurs de l’absorption des amines (amitriptyline, duloxétine, milnacipran) et les bloqueurs des canaux calciques (par exemple : prégabaline, gabapentine) ; ces médicaments ont également des limites cliniques, notamment une efficacité partielle, des effets secondaires et la tendance à avoir un début d’action plus lent que la plupart des opioïdes.
Conclusion
Les recherches d’autres stratégies pour une meilleure gestion de la douleur sont en cours. Actuellement, les perspectives les plus prometteuses sont l’augmentation des actions endogènes des opioïdes et l’activation sélective des récepteurs opioïdes périphériques. Au futur, les stratégies de développement des médicaments analgésiques devraient inclure des partenaires public-privé set des sociétés pharmaceutiques à but non lucratif, comme illustré par les approches visant à réduire la crise de l’infection à VIH ou la résistance aux antibiotiques.7
Références
1- Mercadante, S., Arcuri, E., & Santoni, A. (2019). Opioid-Induced Tolerance and Hyperalgesia. CNS drugs, 33(10), 943–955.
2- DuPen, A., Shen, D., & Ersek, M. (2007). Mechanisms of opioid-induced tolerance and hyperalgesia. Pain management nursing : official journal of the American Society of Pain Management Nurses, 8(3), 113–121.
3- Liu, J. G., & Anand, K. J. (2001). Protein kinases modulate the cellular adaptations associated with opioid tolerance and dependence. Brain research. Brain research reviews, 38(1-2), 1–19.
4- Al-Hasani, R., & Bruchas, M. R. (2011). Molecular mechanisms of opioid receptor-dependent signaling and behavior. Anesthesiology, 115(6), 1363–1381.
5- Zöllner, C., & Stein, C. (2007). Opioids. Handbook of experimental pharmacology, (177), 31–63.
6- Stein C. (2018). New concepts in opioid analgesia. Expert opinion on investigational drugs, 27(10), 765–775.
7- Stein C. (2020). Opioid analgesia: recent developments. Current opinion in supportive and palliative care, 14(2), 112–117.
8- Braz, J., Solorzano, C., Wang, X., & Basbaum, A. I. (2014). Transmitting pain and itch messages: a contemporary view of the spinal cord circuits that generate gate control. Neuron, 82(3), 522–536.
9- Simonnet, G., Laboureyras, E. Les opioïdes: de l’analgésie à l’hyperalgésie. Des dogmes à réexaminer ?. Douleur analg 22, 216–228 (2009).
10- Muller, A., Koch, B., René, F., Boutillier, A. L., See, V., & Loeffler, J. P. (1999). Mécanismes de la tolérance et de la dépendance aux opioïdes. Annales Françaises d’Anesthésie et de Réanimation, 18(8), 866–895.
11- Eidson, L. N., & Murphy, A. Z. (2019). Inflammatory mediators of opioid tolerance: Implications for dependency and addiction. Peptides, 115, 51–58.
12- Holden, J. E., Jeong, Y., & Forrest, J. M. (2005). The endogenous opioid system and clinical pain management. AACN clinical issues, 16(3), 291–301.
13- Wilson-Poe, A. R., Jeong, H. J., & Vaughan, C. W. (2017). Chronic morphine reduces the readily releasable pool of GABA, a presynaptic mechanism of opioid tolerance. The Journal of physiology, 595(20), 6541–6555.
14- Benyamin, R., Trescot, A. M., Datta, S., Buenaventura, R., Adlaka, R., Sehgal, N., Glaser, S. E., & Vallejo, R. (2008). Opioid complications and side effects. Pain physician, 11(2 Suppl), S105–S120.
15- Williams, J. T., Christie, M. J., & Manzoni, O. (2001). Cellular and synaptic adaptations mediating opioid dependence. Physiological reviews, 81(1), 299–343.
16- Jamison, R. N., & Mao, J. (2015). Opioid Analgesics. Mayo Clinic proceedings, 90(7), 957–968.
17- Volkow, N., Benveniste, H., & McLellan, A. T. (2018). Use and Misuse of Opioids in Chronic Pain. Annual review of medicine, 69, 451–465.
18- Lavand’homme, P., & Steyaert, A. (2017). Opioid-free anesthesia opioid side effects: Tolerance and hyperalgesia. Best practice & research. Clinical anaesthesiology, 31(4), 487–498.
19- Cahill, C. M., Walwyn, W., Taylor, A., Pradhan, A., & Evans, C. J. (2016). Allostatic Mechanisms of Opioid Tolerance Beyond Desensitization and Downregulation. Trends in pharmacological sciences, 37(11), 963–976.
20- Volkow, N. D., & McLellan, A. T. (2016). Opioid Abuse in Chronic Pain–Misconceptions and Mitigation Strategies. The New England journal of medicine, 374(13), 1253–1263.
21- Huxtable, C. A., Roberts, L. J., Somogyi, A. A., & MacIntyre, P. E. (2011). Acute pain management in opioid-tolerant patients: a growing challenge. Anaesthesia and intensive care, 39(5), 804–823.
22- Martyn, J., Mao, J., & Bittner, E. A. (2019). Opioid Tolerance in Critical Illness. The New England journal of medicine, 380(4), 365–378.
23- Roeckel, L. A., Le Coz, G. M., Gavériaux-Ruff, C., & Simonin, F. (2016). Opioid-induced hyperalgesia: Cellular and molecular mechanisms. Neuroscience, 338, 160–182.
24- Lee, M., Silverman, S. M., Hansen, H., Patel, V. B., & Manchikanti, L. (2011). A comprehensive review of opioid-induced hyperalgesia. Pain physician, 14(2), 145–161. 25- Lau, B. K., Winters, B. L., & Vaughan, C. W. (2020). Opioid presynaptic disinhibition of the midbrain periaqueductal grey descending analgesic pathway. British journal of pharmacology, 177(10), 2320–2332.