Le Changement pour la Vie
Thinhinane SARI
Venir à la vie est assurément un événement heureux, mais sans doute laborieux. Le fœtus, jusque-là habitant un utérus fécond, y puisant oxygène et nutriments, doit alors achever la maturation de ses organes afin d’établir ses propres échanges gazeux, une fois déconnecté de sa maman. Des changements capitaux surviennent alors au niveau du système cardiovasculaire shunt-dépendant, et des poumons noyés dans leur liquide, ainsi qu’au niveau de la thermorégulation et du métabolisme glucidique, afin d’assurer une transition efficiente du milieu intra-utérin vers le milieu extra-utérin. Des troubles peuvent cependant survenir lors de ce processus, et avoir des répercussions plus ou moins importantes.
Dans cet article, il sera question de traiter de la physiologie de la transition de la vie intra-utérine à la vie extra-utérine.
Afin de pouvoir comprendre la transition de la vie intra-utérine à la vie extra-utérine, il est nécessaire d’avoir un aperçu sur le développement embryologique des appareils cardiovasculaire et pulmonaire, et de comprendre l’organisation de la circulation fœtale mise en place.
Développement du Système Cardiovasculaire Shunt-dépendant
Le cœur est le premier organe à se former durant l’embryogenèse, au vu de l’accroissement des demandes métaboliques.21
Le système cardiovasculaire est majoritairement dérivé du mésoderme, feuillet embryonnaire se situant entre l’endoderme et l’ectoderme, les trois issus de la gastrulation. Des cellules de la crête neurale cardiaque contribuent cependant à la formation des grandes artères.22
Le cœur primordial apparaît au milieu de la troisième semaine de gestation, il commence à battre au 22ème jour, et le sang commence à y circuler durant la quatrième semaine, y pénétrant à travers le sinus veineux.5 Le sang arrive du sac chorionique (futur placenta) dans les deux veines ombilicales droite et gauche vers le cœur primordial ; il est riche en oxygène et en nutriments. Les veines ombilicales s’abouchent dans le cœur primordial mais en seront vite séparées pour venir se déverser dans le foie en développement. La veine ombilicale droite régressera aussitôt.
Le sang pénètre le cœur primordial à travers le sinus veineux vers l’atrium primordial (non encore segmenté), passe par le canal interventriculaire vers le ventricule primordial (non encore segmenté) et se déverse dans le sac aortique. Ce dernier donnera plus tard naissance au tronc pulmonaire et à l’aorte.
A la 8ème semaine de gestation, le cœur est complétement formé.22
Trois shunts assurent la circulation fœtale et permettent au sang de contourner les poumons non encore fonctionnels et le foie : le foramen ovale, le canal artériel et le conduit veineux. Ces deux derniers ont une paroi plus rigide que la paroi de l’aorte et celle de l’artère pulmonaire.
Foramen ovale : le foramen ovale est une communication entre les deux atriums droit et gauche, permettant un shunt droit-gauche.
Ces atriums droit et gauche dérivent de l’atrium primordial précédemment décrit, qui, à la fin de la 4ème semaine du développement embryonnaire,5, 21 se divise en deux chambres, par la formation de deux septa qui sont deux membranes s’évaginant de sa paroi : le septum primum, qui se développe à partir de la paroi postéro-supérieure, et le septum secundum, qui se développe à droite du septum primum.
Le septum primum est le premier à apparaître. Comme c’est une fine membrane en forme de croissant, il formera avec la paroi de l’atrium primordial, une ouverture qui s’appelle « le foramen primum », à travers lequel passera le sang en un shunt droit-gauche. Un peu plus tard, cette ouverture (le foramen primum) sera vite fermée sous l’effet de la fusion du septum primum avec le reste de la paroi de l’atrium primordial. Cependant, sous l’effet de l’apoptose, il se formera une autre ouverture au sein du septum primum, pour permettre de nouveau le shunt droit-gauche ; cette ouverture s’appelle « le foramen secundum ».
Entre temps, le septum secundum, membrane en forme de croissant également mais plutôt rigide, entamera sa croissance. De la même manière, cette membrane formera avec la paroi de l’atrium primordial une ouverture, portant le nom de « foramen ovale ».
Enfin, le foramen secundum va dégénérer, laissant le bord du septum primum libre. Ce dernier formera la valve du foramen ovale, qui se ferme contre lui.
La rigidité du foramen ovale, ainsi que la configuration de sa valve, permettent l’écoulement du sang oxygéné de droite à gauche.5
Canal artériel : le canal artériel est un canal qui nait le plus souvent près de l’origine de l’artère pulmonaire gauche, et qui relie le tronc pulmonaire à l’aorte descendante, en aval de l’origine de l’artère subclavière gauche. Il se développe à partir du sixième arc aortique distal sous l’expression spécifique du gène HoxB522 et, à la fin de la sixième semaine de gestation, il est assez développé pour drainer l’essentiel du flux cardiaque droit.15
Le canal artériel est maintenu ouvert grâce à l’oxygénation réduite et le taux élevé des prostaglandines circulantes qui en résulte, causant la relaxation musculaire de sa paroi.5 En effet, en l’absence d’oxygène, les canaux de potassium voltage-dépendants, présents dans les cellules musculaires lisses du canal artériel, maintiennent celles-ci dans un état d’hyperpolarisation, elles ne se contractent donc pas, maintenant le canal artériel ouvert.10, 25
De même, les prostaglandines E2 et I2, molécules vasodilatatrices, contribuent également à maintenir le canal artériel ouvert ; la prostaglandine E2 est cependant le facteur le plus important à la régulation du tonus ductal durant le développement.24 Elles sont générées par l’action des cyclo-oxygénases 1 et 2 sur l’acide arachidonique. Elles sont sécrétées surtout par le placenta mais aussi par le canal artériel lui-même et les vaisseaux ombilicaux ; leur sécrétion augmente à l’approche du terme, principalement à cause de l’augmentation de leur production par le placenta.24 Elles sont normalement éliminées à leur premier passage pulmonaire mais comme les poumons ne sont pas encore fonctionnels, leur taux reste élevé.15
Conduit veineux : le conduit veineux est un shunt qui permet au sang oxygéné de la veine ombilicale de passer directement dans la veine cave inférieure sans passer par le foie. Il est issu de la veine ombilicale qui se ramifie en un petit sinus porte et un grand conduit veineux.23 Le petit sinus porte drainera le foie.
Le conduit veineux est nécessaire à la circulation fœtale. En effet, lors de son développement, le foie se contracte et comprime avec lui les vaisseaux, ce qui, en l’absence du conduit veineux, va comprimer la veine ombilicale et diminuer le flux du sang oxygéné provenant du placenta vers le cœur, ce qui mène à l’hypoxie.23 Il est aussi maintenu ouvert sous l’effet des prostaglandines qui, une fois liées à leur récepteur, activent la protéine G qui induit une augmentation de l’AMPc, qui mène à la diminution de la concentration du calcium et à la relaxation musculaire vasculaire.24
Développement Pulmonaire
Les bourgeons pulmonaires, dérivés de l’endoderme respiratoire, apparaissent à la fin de la 4ème semaine de gestation. Le développement pulmonaire passe par plusieurs étapes, et n’est achevé qu’à la deuxième année de vie.10
Les poumons fœtaux ne sont pas impliqués dans les échanges gazeux ; ils reçoivent un flux sanguin réduit, et sont remplis de liquide, détecté déjà au 1er trimestre de gestation.7 Ce liquide, sécrété par l’épithélium pulmonaire, diffère dans sa composition chimique du liquide amniotique ; il résulte d’une sécrétion active des ions de chlorure dans la lumière pulmonaire, suivie d’un mouvement d’eau, avec une réabsorption réduite des ions de sodium. Ce liquide appliquera une pression à l’intérieur des poumons, qui, avec les cordes vocales fermées,7, 10 va servir à leur distension. C’est un phénomène absolument nécessaire pour le développement et la maturation pulmonaire ; un volume réduit sera associé à une hypoplasie pulmonaire.4
A partir de la 10ème semaine, le fœtus commence à faire des mouvements respiratoires, bruts et périodiques, durant lesquels les contractions du diaphragme exercent une pression opposée sur les poumons, empêchant ainsi la déflation pulmonaire.10 Ces mouvements sont réactifs à des facteurs maternels : ils augmentent avec l’augmentation de la glycémie maternelle, après un repas. Le tabagisme maternel les réduit.4
A la 26ème semaine, l’épithélium des alvéoles se différencie en deux types cellulaires, les pneumocytes de type I et les pneumocytes de type II. Ces dernières, sous l’effet des hormones thyroïdiennes et des glucocorticoïdes (le cortisol augmentant à partir de la 30ème semaine après maturation des glandes surrénales3), commencent, à partir de la 30ème semaine,10 à sécréter sur la surface alvéolaire le surfactant, qui est une mixture de phospholipides et de protéines permettant de réduire la tension superficielle des alvéoles, réduisant ainsi la force requise pour l’inspiration et l’inflation alvéolaire, et prévenant le collapsus alvéolaire durant l’expiration. Il permet surtout de stabiliser les alvéoles après la naissance lors de l’entrée de l’air. Cette sécrétion atteint son paroxysme durant les dernières semaines de gestation.4
Toute maturation est une accumulation, elle requiert du temps et de l’acharnement. Durant ses 9 mois de développement, l’organisme fœtal se construit petit à petit, avec une cadence concordante avec ses capacités de prolifération et de différentiation. Les différents appareils sont mis en place mais, comme ils ne peuvent fonctionner indépendamment les uns des autres, ils doivent établir une certaine harmonie, qui assurera et potentialisera leurs actions.
Circulation Fœtale
Chez l’embryon, les poumons se développent tardivement, et ne sont pas impliqués dans les échanges gazeux durant la vie fœtale. Leur rôle est alors assuré par le placenta, un organe fœtal qui reçoit 40% du flux cardiaque fœtal.7 Il assure les échanges gazeux et nutritionnels de la maman au fœtus. C’est une circulation shunt-dépendante : le ventricule droit dirigeant l’essentiel de son flux de sang désoxygéné vers le placenta grâce au canal artériel, et le ventricule gauche se remplissant de sang oxygéné grâce au foramen ovale ; un sang qu’il dirigera vers le cerveau, le cœur et la partie supérieure du corps.
Tout commence au niveau du placenta, qui est de faible résistance. Le sang maternel riche en oxygène arrive des artères utérines dans l’espace placentaire. Selon son gradient de concentration, l’oxygène diffuse de l’espace placentaire à travers des villosités tapissant la face fœtale du placenta, vers les capillaires contenus dans ces villosités. Ces capillaires fusionnent et forment la veine ombilicale dans le cordon ombilical.
Au niveau du fœtus, le sang de la veine ombilicale, sous haute pression sous l’effet des contractions utérines,4 avec une saturation en oxygène de 70 à 80% qui est la plus élevée de la circulation fœtale,3, 7 rejoint le conduit veineux, qui est connecté à la veine cave inférieure près de sa jonction avec l’atrium droit. Là, une partie du flux passe directement à travers le shunt, tandis que l’autre partie se dirige vers les capillaires hépatiques et le système porte. Ceci est permis grâce à un sphincter physiologique au niveau du conduit veineux, afin de diminuer la pression du sang désoxygéné de la veine cave inférieure et lui permettre ainsi de pénétrer l’atrium droit.4, 5
Le sang oxygéné du conduit veineux reste sur la partie postérieure et gauche de la veine cave inférieure, et a tendance à diffuser séparément du sang veineux systémique de la partie inférieure du corps, pauvre en oxygène.
Au niveau du cœur, le sang de la veine cave inférieure se divise en deux courants. Le courant riche en oxygène est préférentiellement shunté à travers le foramen ovale vers l’atrium gauche, tandis que l’autre courant, pauvre en oxygène se joint au sang désoxygéné provenant de la veine cave supérieure et du sinus coronaire, et se déverse dans le ventricule droit. Seulement 5% du sang de la veine cave supérieure passe à travers le foramen ovale vers l’atrium gauche.
Ainsi, le sang riche en oxygène et celui pauvre en oxygène ne se mélangent pas. Ceci est dû à plusieurs mécanismes1 :
- L’angle que forme le conduit veineux lors de sa jonction avec la veine cave inférieure fait que son flux soit dirigé vers le foramen ovale.
- La valvule de la veine cave inférieure dirige son flux vers le septum atrial.
- La vélocité élevée du flux provenant du conduit veineux (55cm/s), comparée à celle du flux de la veine cave inférieure (15 cm/s), contribue à maintenir la distribution préférentielle du flux du conduit veineux à travers le foramen ovale.
Le sang riche en oxygène se trouve alors au niveau de l’atrium gauche, il constituera 25% du flux cardiaque total.3 Là, il sera mélangé avec une petite quantité de sang désoxygéné provenant des poumons à travers les veines pulmonaires, pour se déverser dans le ventricule gauche puis dans l’aorte ascendante, où il sera dirigé vers les artères coronaires, les artères de la tête et du cou, ainsi qu’aux artères des membres supérieurs, avec une saturation de 65%.3 Seulement 10% de ce flux arrive à l’aorte descendante.1
Comme les poumons du fœtus sont remplis de liquide, et ayant une résistance vasculaire élevée suite à la vasoconstriction due à l’hypoxie fœtale relative, seulement une petite proportion (10-25%)1, 5, 7, 8, 10 du sang désoxygéné provenant du ventricule droit arrivera aux poumons, avec une saturation avoisinant 50%,4 le reste rejoint l’aorte descendante, en passant par le shunt du canal artériel qui est situé en aval de l’artère subclavière gauche, reliant le tronc artériel à l’aorte. Ce sang, saturé à 60%,3 supplémente les viscères abdominaux et les membres inférieurs, puis rejoint les artères iliaques internes et sera shunté vers le placenta à travers les deux artères ombilicales, dans le cordon ombilical.
L’hypoxémie relative chez le fœtus induit le facteur 1 hypoxie-inductible à stimuler les reins fœtaux pour produire l’érythropoïétine,3 conduisant à la production des globules rouges. L’hémoglobine fœtale a une plus grande capacité à se lier à l’oxygène que l’hémoglobine adulte, afin de permettre son transfert de la maman au fœtus ; ceci altère en contrepartie sa distribution vers les capillaires tissulaires fœtaux. La production d’hémoglobine fœtale se poursuivra jusqu’à 6 mois de vie.
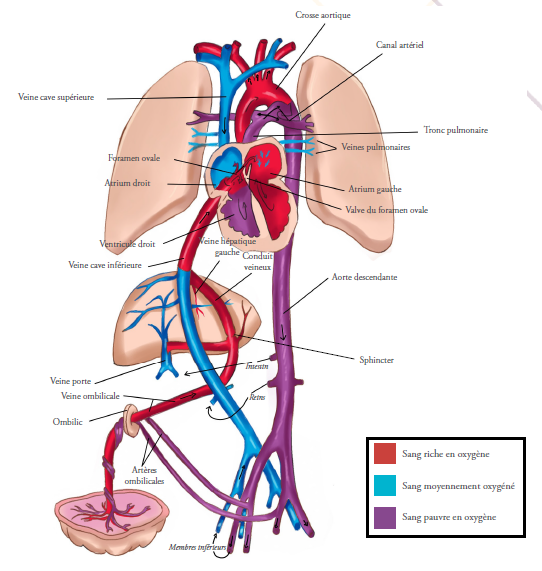
Figure 1 : Circulation foetale.
Adaptée de : Keith L. Moore, T.V.N. Persaud, Mark G. Torchia. The Developing Human Clinically Oriented Embryology. 9th ed: Elsevier, Philadelphia; 2013.
Reproduction de Sara KHERMANE
Comme après toute accumulation, lente et laborieuse comme le veut la nature, des changements bruts doivent survenir pour mettre en œuvre le potentiel jusque-là acquis, afin de franchir de nouveaux horizons. A terme, le fœtus s’apprête alors à quitter l’utérus de sa maman, et venir au monde. Si né prématurément, manquant certaines étapes de sa maturation, le nouveau-né sera sujet à de nombreuses dysfonctions.
Transition
La transition de la vie intra-utérine à la vie extra-utérine commence avant le début du travail.7 Elle se caractérise par des changements cardiovasculaires et pulmonaires afin d’assurer les échanges gazeux après la coupure du cordon ombilical.
Changements pulmonaires
A la fin de la grossesse, les poumons sont en expansion, avec une tension alvéolaire basse grâce au surfactant, dont la sécrétion augmente encore avec le travail et l’initiation de la ventilation.3 Ils sont cependant remplis de liquide, et doivent alors subir une clairance. La clairance alvéolaire commence avant la naissance, elle est augmentée avec le travail et prend fin à 2 heures de vie.3
Cette clairance est médiée par l’adrénaline dont le taux augmente avec le début du travail.10 Elle est établie grâce au changement épithélial pulmonaire d’une sécrétion active de liquide à une absorption active de sodium et d’eau à travers les canaux sodiques jusque-là peu actifs, et ce grâce à l’augmentation du taux des hormones thyroïdiennes et du cortisol. Ces hormones induisent une augmentation du nombre des récepteurs bêta-adrénergiques7 au niveau du poumon, ainsi qu’une augmentation de l’expression des gènes codant pour les canaux sodiques épithéliaux (expression maintenue par l’augmentation de la pression de l’oxygène à la naissance2, 3). Avec l’augmentation de la pression intra-utérine durant le travail et les compressions thoraciques lors du passage à travers la filière génitale, les pressions intra-abdominale et intra-thoracique fœtales s’élèvent et induisent encore un efflux du liquide pulmonaire.2, 7, 10
Cette clairance sera également établie grâce aux premiers soupirs. Ils sont déclenchés et maintenus par la baisse brutale de la température ambiante (du milieu intra-utérin au milieu extra-utérin), ainsi que par l’hypoxie, les compressions vaginales, les pleurs et les stimulations sensorielles.16 Les premiers soupirs augmentent la pression intra-pulmonaire de -50 cm H2O à l’inspiration à 70 cm H2O à l’expiration approximativement, conduisant à un transport d’eau et de sodium vers l’interstitium et les vaisseaux pulmonaires.2, 7, 10
La clairance, l’expansion physique pulmonaire, ainsi que l’augmentation de l’oxygène, qui est un vasodilatateur pulmonaire à travers la synthèse de monoxyde d’azote, conduisent à une diminution des résistances vasculaires.7, 8
Les nouveau-nés prématurés, ainsi que ceux accouchés par césarienne, manquant certains ou la totalité de ces phénomènes, peuvent avoir une transition laborieuse.
Changements cardiovasculaires
Ils se caractérisent par le changement des pressions vasculaires pulmonaires et systémiques et la fermeture des shunts.
Dès lors que le cordon ombilical est clampé, le lit placentaire de faible résistance est déconnecté, les résistances vasculaires systémiques du nouveau-né augmentent alors, induisant une augmentation de la pression aortique, en aval de l’atrium gauche. D’autre part, les résistances vasculaires pulmonaires, en amont de l’atrium gauche, sont diminuées avec la clairance et la ventilation, conduisant à une augmentation de leur flux sanguin. Ceci conduit à une augmentation de la pression de l’atrium gauche qui va devenir supérieure à celle de l’atrium droit. La valve du foramen ovale se ferme alors contre le septum secundum, le foramen ovale est ainsi fermé.3, 8, 5
Ce changement de pressions induit également une inversion du shunt au niveau du canal artériel durant les 10 premières minutes de vie, qui peut durer jusqu’à 24 à 48 heures.7, 5, 10 Ceci permet un flux sanguin riche en oxygène au travers du canal artériel. Cette augmentation en oxygène est détectée par les cellules musculaires lisses du canal artériel, via un réseau mitochondrial dynamique.26, 27 Elle va provoquer une inhibition des canaux potassiques voltage-dépendants, causant une dépolarisation au niveau des cellules musculaires lisses ductales qui va activer les canaux calciques L-Type menant à un influx de calcium en intracellulaire, et va entrainer la constriction du canal artériel et sa fermeture fonctionnelle.3, 7, 8, 10, 26 Des données existent également suggérant la participation du cytochrome P450 et de l’endothéline-1 dans la constriction du canal artériel induite par l’oxygène,26, 27 ainsi que le possible rôle de l’acide rétinoïque.26 D’autres substances, comme l’adrénaline, la noradrénaline, l’acétylcholine et la bradykinine, peuvent aussi contribuer à la vasoconstriction du canal artériel,5, 15, 27 ainsi que l’hypo-osmolarité, comme suggéré dans certaines études récentes.26
Aussi, le placenta étant la principale source des prostaglandines, une fois déconnecté, le taux de ces dernières baisse. Avec l’augmentation du flux sanguin pulmonaire, et l’augmentation du taux de la prostaglandine déshydrogénase circulante,25 les prostaglandines encore circulantes sont éliminées en majeure partie à leur premier passage pulmonaire, ce qui conduit à la baisse de leur taux.15, 16 La baisse de l’expression de leur récepteurs à terme mène à une diminution de la sensibilité à leur action dilatatrice,24 et l’augmentation de l’oxygène dans le canal artériel diminue leur disponibilité locale5, 8 par l’augmentation de l’activité locale de la phosphodiestérase.24 Le taux des prostaglandines est alors globalement diminué, ce qui conduit à la perte de la vasodilatation du canal artériel, et sa fermeture.
Une fois la fermeture fonctionnelle achevée, certains remodelages ont lieu au niveau du canal artériel afin d’obstruer sa lumière et conduire à sa fermeture anatomique. C’est un mécanisme complexe, impliquant la migration des cellules musculaires lisses du canal artériel de la media vers l’espace sous-endothélial, la prolifération de la matrice extracellulaire dans cet espace, la prolifération des cellules endothéliales et l’interaction des cellules sanguines.
En effet, la fermeture anatomique commence avec la séparation de la couche endothéliale de l’intima du canal artériel de la limitante élastique interne qui lui est sous-jacente, libérant ainsi un espace sous-endothélial où vient se déposer la matrice extracellulaire. Sous l’influence de certains facteurs, les cellules musculaires lisses indifférenciées de la media vont migrer vers cet espace sous endothélial, afin d’épaissir l’intima. Les cellules endothéliales prolifèrent et migrent à leur tour, influencées aussi par certains facteurs. Les éléments sanguins circulants dans la lumière ductale sont recrutés et contribuent également à ce remodelage, notamment les cellules mononucléaires et les plaquettes. Enfin, l’hypoxie du flux luminal causée par la fermeture fonctionnelle produit une zone hypoxique dans la media du canal artériel, ce qui mène à l’apoptose cellulaire et la fibrose (voir Figure 2). Cet ensemble de mécanismes va obstruer petit à petit la lumière du canal artériel, et mener à sa fermeture anatomique, qui aura lieu quelques jours à quelques semaines après la naissance.10, 15, 26, 28 Ainsi, le canal artériel devient le ligament artériel,8, 15, 21, 25 qui va souvent se calcifier.13, 28
Chez les nouveau-nés avec hypoxie persistante, le canal artériel peut rester ouvert plus longtemps.5
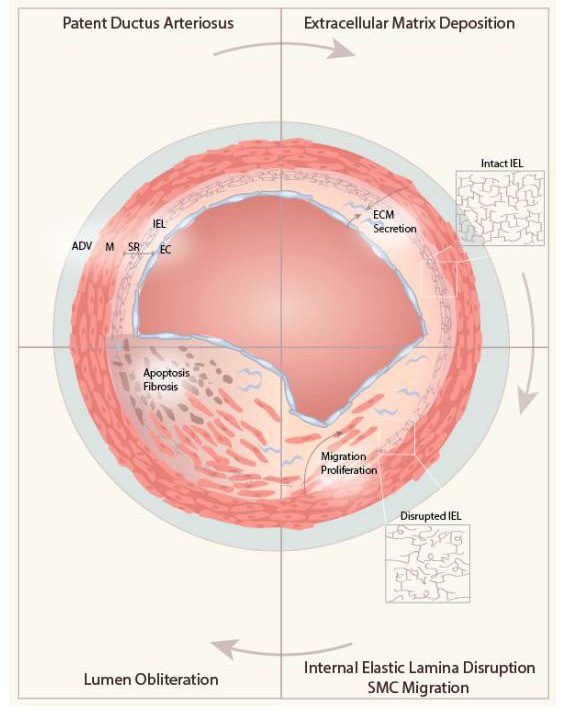
Figure 2 : Étapes requises pour l’épaississement de la paroi du canal
artériel et sa fermeture anatomique.
ADV : adventitia, M : media, SR : subendothelial region, EC : endothelial
cell, IEL : internal elastic lamina, ECM : extracellular matrix.
Tirée de : Ting-Yi Lin, Jwu-Lai Yeh, Jong-Hau Hsu. Role of Extracellular
Matrix in Pathophysiology of Patent Ductus Arteriosus: Emphasis on Vascular
Remodeling. Int. J. Mol. Sci. 2020, 21(13), 4761.
L’échec de fermeture du canal artériel les quelques semaines après la naissance et sa persistance est une maladie congénitale qui touche environ 1 sur 2000 nouveau-nés à terme.12, 25 Elle peut rester asymptomatique jusqu’à la vie adulte et causer une hypertension pulmonaire, ou être bruyante et se manifester dès les premiers jours de vie chez les prématurés, chez qui elle peut causer un état hémodynamique dangereusement instable. De ce fait, il est nécessaire de savoir reconnaitre une telle situation clinique, et agir à temps. L’ibuprofène et l’indometacine, inhibiteurs de la production de prostaglandines, sont utilisés pour fermer médicalement le canal artériel patent chez les prématurés.5, 20 Une persistance du canal artériel symptomatique ou hemodynamiquement instable est une indication à l’intervention. Deux volets thérapeutiques sont disponibles : l’occlusion chirurgicale, ou interventionnelle qui est devenue l’alternative à la chirurgie.15, 20 Il est entendu de ne fermer par trans-cathétérisation que les canaux artériels cliniquement audibles, signe d’un shunt gauche-droit important.12
Dans certaines affections ducto-dépendantes, comme l’atrésie pulmonaire et la tétralogie de Fallot, le canal artériel est maintenu ouvert temporairement en administrant la prostaglandine E1, en attendant la procédure interventionnelle.14 (cf. Laboudi A. La Tétralogie de Fallot – La Maladie Bleue. Medpress. 2020;5)30.
Enfin, un dernier shunt à se fermer, le conduit veineux. Sa vasoconstriction est précédée par la vasoconstriction des artères ombilicales, sous l’influence de l’augmentation de l’oxygène. La veine ombilicale reste entre temps dilatée mais le sphincter du conduit veineux subit une vasoconstriction, de sorte que tout le sang entrant au foie passe par les capillaires hépatiques.5 Il finira par se fermer suite à l’interruption du flux placentaire.10
Après la naissance, le segment pré-hépatique de la veine ombilicale atrophiée deviendra le ligament rond du foie, tandis que le conduit veineux, totalement fermé dans les 3 mois de vie, deviendra le ligament veineux du foie.10, 23 A noter que le conduit veineux peut échouer à se fermer et demeurer patent, et fera alors office de shunt veineux porte-systémique. Ce phénomène peut rester sans conséquence comme il peut mener à une dysfonction hépatique et une hypertension portale. C’est une situation rare, dont le traitement est chirurgical.23
Le clampage du cordon ombilical avant l’initiation de la ventilation provoque une augmentation des pressions systémiques avant que les pressions vasculaires pulmonaires baissent et que le flux sanguin pulmonaire augmente, ce qui induit une diminution de la précharge du ventricule gauche et une diminution du volume d’éjection. Dans ce sens, retarder le clampage du cordon jusqu’à 1 à 3 minutes de vie chez les nouveau-nés à terme, jusqu’à ce que la ventilation commence et les pulsations dans le cordon baissent, semble être bénéfique.3, 7, 9
Pour terminer, un mot sur le débit cardiaque, qui augmente au cours de la transition. En effet, l’augmentation de la réactivité bêta-adrénergique, médiée par les hormones thyroïdiennes aux dernières semaines de gestation, potentialise la réponse du cœur aux catécholamines, dont le taux augmente avec le travail. Aussi, la diminution de la postcharge ventriculaire droite après la naissance réduit probablement l’effet contraignant du ventricule droit sur le ventricule gauche, permettant à ce dernier de se contracter plus efficacement en réponse à la forte augmentation de la précharge à la naissance. Enfin, le débit cardiaque est augmenté par l’accélération des fonctions cardiaques et thermorégulatrices après la naissance.10
Thermorégulation
La température fœtale est supérieure de 0.5°C à la température maternelle, elle varie entre 37.6°C et 37.8°C ; le transfert de chaleur se fait donc du fœtus vers la maman, via le placenta et la peau.17, 18
A sa naissance, avec la déconnection du placenta, la baisse rapide de la température ambiante et la grande surface corporelle du nouveau-né par rapport à son poids (3 fois l’adulte), des pertes de chaleur surviennent à travers l’évaporation du liquide amniotique qui recouvre le nouveau-né, la conduction, la convection et la radiation thermiques. Le nouveau-né doit donc pouvoir compenser et maintenir sa température corporelle ; mais comme sa capacité de frissonner est réduite par rapport à celle de l’adulte, il a recours à la thermorégulation chimique.3, 16-18
En effet, le changement de température stimule les thermorécepteurs cutanés, qui à leur tour induisent l’augmentation de sécrétion de la noradrénaline par les extrémités nerveuses du système nerveux autonome de la graisse brune richement vascularisée. Ceci provoque une vasoconstriction périphérique et une augmentation du métabolisme, ainsi qu’une stimulation de la sécrétion des hormones thyroïdiennes qui, en agissant sur la protéine thermogénine, induisent une production de chaleur à travers l’oxydation des acides gras et le découplage de la phosphorylation oxydative.16-18
A noter que la position en quadri-flexion du nouveau-né réduit la surface corporelle exposée à l’air et contribue aussi au maintien de la température corporelle.16
L’OMS recommande le maintien de la température axillaire des nouveau-nés entre 36.5°C et 37.5°C.17 Pour ce faire, depuis 1997, elle recommande 10 étapes de « chaine du chaud » : chauffer la salle d’accouchement à au moins 25°C, commencer à sécher le nouveau-né immédiatement avant même de couper le cordon, et lui faire porter ses habits, tenir le nouveau-né peau-à-peau (maman kangourou) ou sur une surface chaude, commencer de l’allaiter, retarder le bain et la pesée, ainsi qu’un entrainement adéquat de tout le personnel pour reconnaître et savoir gérer un état de stress provoqué par le froid.16
Homéostasie du Glucose
Durant la vie fœtale, le métabolisme est au ralenti, similaire à celui de la femme enceinte.3 Le glucose représente la moitié des besoins énergétiques totaux,18 il diffuse à travers le placenta, et son flux dépend de la glycémie maternelle. L’insuline est produite par le fœtus, car elle ne peut pas traverser le placenta.
A la naissance, le nouveau-né doit produire le glucose indépendamment du placenta duquel il est alors séparé. Son métabolisme s’accélère avec une augmentation de la densité mitochondriale.3 Comme la naissance est une période de stress, la demande en glucose augmente ; le taux de catécholamines fœtales augmente, et le glycogène est mobilisé. La grande consommation de glucose mène cependant à la diminution de son taux ; en réponse à cette baisse, le taux de glucagon augmente et active la néoglucogenèse.
Comme le volume du cerveau du nouveau-né est proportionnellement plus important que la masse corporelle, les besoins en glucose sont 2 à 3 fois plus importants que chez l’adulte.19 Le principal carburant du cerveau est le glucose ; toutefois en cas de manque, le foie augmente la production des corps cétoniques à partir de l’oxydation des acides gras après les 12 premières heures de vie, qui sont capables de pallier au manque de glucose.3, 18, 19
Des taux bas de glucose sont généralement observés chez les nouveau-nés sains durant les 24 à 48h de vie, comparés aux enfants plus âgés et aux adultes,19 d’où la nécessité de tétées régulières et fréquentes durant les premiers jours de vie, afin de prévenir l’hypoglycémie qui peut être sévère et persistante chez le nouveau-né, et peut être associée à des convulsions et à une altération du développement nerveux, malgré le manque de données claires concernant le sujet.19
En Résumé
L’adaptation extra-utérine regroupe un ensemble de changements, principalement cardiovasculaires axés sur le jeu de pressions et de résistances et la fermeture des shunts, et pulmonaires, les poumons étant remplis de liquide in utero, et devant subir une clairance afin de pouvoir initier la ventilation et assurer les échanges gazeux. Elle peut cependant être altérée par la persistance d’un des shunts – le canal artériel patent représente l’une des malformations cardiaques les plus courantes -, comme elle peut être altérée par l’hypoxie ou l’hypothermie néonatales, et avoir des conséquences à court et à long terme. De là, la nécessité de suivre cette transition physiologique avec soin.
Les grands changements sont souvent porteurs d’espoir, aussi douloureux et pénibles puissent-ils paraître. La naissance est un phénomène considéré anodin, car fréquent, mais il renseigne en réalité sur la vie et sa philosophie, l’humain et son cheminement, et offre une preuve des plus évidentes sur le caractère cyclique et spiral de toute évolution. Tous les pleurs ne sont finalement pas malheureux ; les premiers, en l’occurrence, sont sans doute l’équivalent d’un Hallelujah !
Références
1- IB Vijayalakshmi. A Comprehensive Approach to Congenital Heart Diseases. 1st ed: Jaypee Brothers Medical Publishers, New Delhi, London, Philadelphia, Panama; 2013.
2- Caraciolo J Fernandes. Physiologic transition from intrauterine to extrauterine life. UpToDate. 2018.
3- Morton, S. U., & Brodsky, D. (2016). Fetal Physiology and the Transition to Extrauterine Life. Clinics in Perinatology, 43(3), 395–407.
4- Bruce M. Carlson. Human Embryology and Developmental Biology. 6th ed: Elsevier; 2018.
5- Keith L. Moore, T.V.N. Persaud, Mark G. Torchia. The Developing Human Clinically Oriented Embryology. 9th ed: Elsevier, Philadelphia; 2013.
6- Zahid Amin, Jonathan M. Tobis, Horst Sievert, John D. Patent Foramen Ovale. 2015th ed: Carroll Editors, Spingler; 2015.
7- Swanson, J. R., & Sinkin, R. A. (2015). Transition from Fetus to Newborn. Pediatric Clinics of North America, 62(2), 329–343.
8- Michael D. Freed. Hurt’s the Heart; Chapter 63: The pathology, recognition, and treatment of congenital heart disease. 2002.
9- Rabe, H., & Andersson, O. (2019). Maternal and Infant Outcomes After Different Methods of Umbilical Cord Management. JAMA, 322(19), 1864.
10- Abdelaziz Y. Elzouki, Harb A. Harfi, Hisham M. Nazer, F. Bruder Stapleton, William Oh and, Richard J. Textbook of Clinical Pediatrics. 2nd ed: Whitley (Editors); 2012.
11- Epstein, J. A. (2010). Cardiac Development and Implications for Heart Disease. New England Journal of Medicine, 363(17), 1638–1647.
12- Horst Sievert, Shakeel A. Qureshi, Neil Wilson, Ziyad M. Hijazi. Interventions in Structural, Valvular, and Congenital Heart Disease. 2nd ed: Taylor & Francis Group, LLC; 2015.
13- Randy Ray Richardson. Atlas of Pediatric Cardiac CTA, Congenital Heart Disease. 2013th ed: Springer Science+Business Media, New York; 2013.
14- Ricardo Munoz, Eduardo M. da Cruz, Carol G. Vetterly, David S. Cooper, Donald Berry. Handbook of Pediatric Cardiovascular Drugs. 2nd ed : Spingler ; 2014.
15- M Payot, Y Aggoun. Persistance du canal artériel et anomalies pouvant le simuler. 2004th ed: Encyclopédie médico-chirurgicale; 2004.
16- B. J. Snell, Sandra L. Gardner. (2017). Care of the well newborn. J and B learning.
17- Roychoudhury, S., & Yusuf, K. (2017). Thermoregulation: Advances in Preterm Infants. NeoReviews, 18(12), e692–e702.
18- Petty, J. (2010). Fact sheet: Normal post natal adaptation to extrauterine life –b) Thermoregulation and glucose homeostasis. Journal of Neonatal Nursing, 16(5), 198–199.
19- Thompson-Branch, A., & Havranek, T. (2017). Neonatal Hypoglycemia. Pediatrics in Review, 38(4), 147–157.
20- Puri, K., Allen, H. D., & Qureshi, A. M. (2017). Congenital Heart Disease. Pediatrics in Review, 38(10), 471–486.
21- Mathew P, Bordoni B. Embryology, Heart. [Updated 2020 Apr 27]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK537313/
22- Schleich, J.-M., Abdulla, T., Summers, R., & Houyel, L. (2013). An overview of cardiac morphogenesis. Archives of Cardiovascular Diseases, 106(11), 612–623.
23- Sidhu PS, Lui F. Embryology, Ductus Venosus. [Updated 2019 Oct 4]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2020 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK547759/
24- Majed BH, Khalil RA. Molecular mechanisms regulating the vascular prostacyclin pathways and their adaptation during pregnancy and in the newborn. Pharmacol Rev. 2012;64(3):540-582.
25- Thomas Doyle, Ann Kavanaugh-McHugh. Clinical manifestations and diagnosis of patent ductus arteriosus in term infants, children, and adults. UpToDate. 2018.
26- Hung, Y.-C., Yeh, J.-L., & Hsu, J.-H. (2018). Molecular Mechanisms for Regulating Postnatal Ductus Arteriosus Closure. International Journal of Molecular Sciences, 19(7), 1861.
27- Crockett, S. L., Berger, C. D., Shelton, E. L., & Reese, J. (2018). Molecular and mechanical factors contributing to ductus arteriosus patency and closure. Congenital Heart Disease.
28- Ting-Yi Lin, Jwu-Lai Yeh, Jong-Hau Hsu. Role of Extracellular Matrix in Pathophysiology of Patent Ductus Arteriosus: Emphasis on Vascular Remodeling. Int. J. Mol. Sci. 2020, 21(13), 4761.
29- https://www.who.int/fr
30- Laboudi A. La Tétralogie de Fallot – La Maladie Bleue. Medpress. 2020;5

