Blouses Blanches & Caséum
Rihab FELLAH
Nour El Houda MAHDI
La tuberculose, une maladie endémique qui semble avoir bel et bien existé de tout temps, reste un problème de santé publique menaçant l’humanité. Ce problème a cependant changé de facette d’une part par l’apparition de mycobactéries dites multirésistantes, voire même ultrarésistantes, et d’autre part, par sa forte prévalence chez les personnes vivant avec le VIH. Étant un pays où la tuberculose est endémique, l’Algérie reste accablée. Ainsi, faisant partie du personnel de santé pouvant y faire face, le sachant ou non, un risque surajouté existe pour nous. Quelle est notre part de danger dans cette situation et comment pouvons-nous nous protéger et protéger les autres ? La science aujourd’hui est-elle encore loin de résoudre ce dilemme ? Le présent article est une modeste tentative de mettre l’accent sur cette pathologie sous-estimée et des menaces qui résultent d’une exposition hasardeuse des travailleurs de santé à ce pathogène redoutable.
Introduction
La tuberculose (TB) est une maladie infectieuse aéroportée causée par des organismes du complexe Mycobacterium tuberculosis (MTBC) dont l’espèce Mycobacterium tuberculosis sensu stricto ou Mtb est la cause de la majeure partie des tuberculoses humaines. Bien qu’il soit un pathogène principalement pulmonaire, le Mtb peut atteindre tous les tissus du corps. 1
Selon les données du bulletin de l’OMS de 2019, environ un quart de la population mondiale est infecté par le Mtb. On estime qu’environ 10 millions de personnes ont contracté la tuberculose en 2018. De plus, la TB est la première cause de décès due à un pathogène infectieux dépassant en nombre le VIH.2 Sur le plan géographique, la charge de morbidité tuberculeuse est répartie de façon hétérogène. Les pays à revenu élevé ont les taux les plus bas de tuberculose active, généralement inférieurs à 10 cas pour 100 000 habitants par an. À l’inverse des pays à faible revenu qui ont des taux de tuberculose plus élevés.1,3
L’Algérie est actuellement un pays à prévalence modérée avec une incidence totale de 69 cas pour 100.000 habitants en 2018.4 L’incidence de la maladie a diminué considérablement et cela grâce au Programme National de Lutte contre la Tuberculose qui suit les recommandations de l’OMS.
Grâce à un diagnostic rapide et à un traitement basé sur une association fixe d’antibiotiques antituberculeux pendant une longue durée (au moins 6 mois), la plupart des patients peuvent être guéris et la transmission ultérieure de l’infection peut être réduite. Cette association comprend des molécules bactéricides : Rifampicine (R), Isoniazide (H) et Pyrazinamide (Z), et bactériostatiques : Ethambutol (E), qui sont des antituberculeux de première lignée et qui permettent d’agir à la fois sur les bacilles intra- et extracellulaires ainsi que ceux en multiplication active.5 Cette association prévient aussi l’émergence de mutants résistants. Malgré cela, des phénomènes de résistance aux antituberculeux seraient favorisés lorsque le traitement est incomplet ou mal suivi par le malade, rendant la gestion de l’infection plus difficile.5
Pathogénie
L’histoire naturelle de la tuberculose est définie par sa voie de transmission aérienne et par la diversité de ses manifestations cliniques. L’Homme s’infecte par l’inhalation de gouttelettes de Flügge – particules infectieuses aérsolisées émises par une personne atteinte de tuberculose pulmonaire bacillifère lors de la toux, des éternuements ou de la parole. Ces gouttelettes sèchent en suspension dans l’air et peuvent rester suspendues pendant de longues périodes.1, 5, 6
Quelle est la dose infectieuse inhalée nécessaire pour induire une tuberculose ? On ne peut le savoir de façon certaine mais on présume que théoriquement un seul bacille peut induire la maladie s’il réussit à échapper aux mécanismes de défense de l’hôte.7, 8
En atteignant l’arbre respiratoire, le Bacille de Koch peut être éliminé par les barrières mécaniques ; si cela ne se produit pas, le Mtb infecte les macrophages alvéolaires. Une fois internalisé, il bloque activement la fusion du phagosome avec le lysosome, assurant ainsi sa survie à l’intérieur de la cellule.1
Après avoir infecté les macrophages alvéolaires, le M. tuberculosis accède à l’interstitium pulmonaire où le processus infectieux évolue. Les cellules dendritiques ou les monocytes le transportent vers les ganglions lymphatiques. Ceci conduit au recrutement de cellules immunitaires en direction du parenchyme pulmonaire pour former un granulome ou tubercule.
Le granulome est une tentative des cellules immunitaires de circonscrire les bacilles et les cellules infectées. Il s’y associe une sécrétion massive d’enzymes lysosomales et lytiques par les macrophages stimulés, pouvant induire une nécrose tissulaire. Cette dernière ressemblant à du fromage, est dite caséeuse. C’est la lésion histologique spécifique de la tuberculose.
Chez la plupart des individus infectés, la combinaison de macrophages, de cellules dendritiques et de cellules T est suffisante pour contrôler l’infection : c’est la tuberculose « latente ». Cependant, chez un certain nombre d’individus, pour des raisons qui ne sont pas complètement claires, l’infection peut évoluer vers une maladie clinique, après des semaines jusqu’à des décennies : c’est la tuberculose « active », pulmonaire ou extra-pulmonaire. Ainsi, la tuberculose se manifeste par un spectre dynamique allant d’une infection asymptomatique à une maladie grave pouvant être mortelle.1
Sur le plan immunologique, la tuberculose est le prototype des infections qui nécessitent une réponse immunitaire cellulaire pour leur contrôle. Cette réponse immunitaire efficace contre l’infection à M. tuberculosis repose sur les cellules T CD4+, l’interleukine (IL)-12, l’interféron-gamma (IFNγ) et le facteur de nécrose tumorale (TNF). Toutefois, M. tuberculosis peut s’adapter à l’immunité de l’hôte et dépend probablement de cette dernière pour faciliter sa propagation à travers les lésions tissulaires et la formation de cavités pulmonaires nécessaires à sa propre transmission. Dans ce cas-là, l’accumulation de larges concentrations d’antigène mycobactérien dans les tubercules, provoque une stimulation chronique de LT CD4+ et des macrophages. La sécrétion accrue d’enzymes lytiques qui en résulte liquéfie le caséum et favorise la prolifération des bacilles en dehors des cellules. Ceci profitera à la bactérie par la rupture des lésions et la dissémination des particules infectantes dans le poumon, le sang et vers d’autres organes (os, rein, méninges, etc.).9
La participation de l’immunité humorale dans la protection contre la tuberculose a été longtemps discutée. Elle prend toute son importance étant donné que la majorité des vaccins commercialisés induit une immunité humorale. La controverse repose dans le fait que : 1) le BK est un germe intracellulaire et ne peut être neutralisé par les immunoglobulines extracellulaires. 2) Certains isotypes d’immunoglobulines sont associés à une mauvaise évolution de la maladie, ce qui suggère leur possible pathogénicité. 3) Les souris ayant un déficit en LT CD4+ sont plus susceptibles à la tuberculose alors que celles avec un déficit en LB ne le sont pas. Il est important de souligner aussi que, quoique le BCG protège des formes graves et mortelles de la tuberculose chez les enfants,1 il n’induit pas chez ces derniers un profil cytokinique compatible avec une réponse Th1.11 De plus, certains sujets sont dits résistants au Mtb. Ils sont capables d’épurer tous les bacilles sans induire une immunité cellulaire mémoire et leurs tests immunologiques sont négatifs. Ils présentent par ailleurs des IgG et IgM dirigées contre les antigènes du Mtb.
Il existe aujourd’hui de plus en plus de données suggérant une coopération complexe et complémentaire d’une réponse Th1 et Th2. Ceci devrait être pris en considération notamment dans les recherches qui visent à développer un vaccin efficace contre la tuberculose.10, 11 ,12
Tuberculose chez les professionnels de la santé
L’incidence de la tuberculose due à l’exposition professionnelle chez les travailleurs de la santé a été estimée entre 2,6% et 11,3% dans les pays à revenu faible et intermédiaire (PRFI). Le risque annuel moyen de développer une tuberculose chez eux est trois fois plus élevé que celui de la population générale.13 Ce risque est plus élevé pour le personnel lorsqu’un patient hospitalisé a une tuberculose pulmonaire non diagnostiquée surtout si les mesures de protection et d’isolement ne sont pas instituées. De même que le cas d’une mauvaise évolution sous traitement à cause d’une souche de Mtb résistante, à savoir, une tuberculose multirésistante MDR (résistante à l’isoniazide et la rifampicine simultanément) ou ultrarésistante XDR-TB (résistante à l’isoniazide et la rifampicine ainsi qu’à toutes les fluoroquinolones antituberculeuses et un antituberculeux injectable de deuxième ligne). En plus de prendre du temps pour être diagnostiquée, la tuberculose résistante requiert un traitement qui dure plus longtemps et qui est de surcroit moins efficace. Le contact prolongé avec ces patients augmente le potentiel de transmission de souches de Mtb résistante aux travailleurs de la santé (TS).
De nombreux autres facteurs influencent le risque de transmission et de progression vers une maladie active, notamment le milieu de soins et la catégorie professionnelle, la sensibilité individuelle ainsi que le statut immunitaire, et enfin les mesures de lutte sanitaire contre cette infection.13
Concernant la profession, les infirmières constituent le premier groupe professionnel identifié comme présentant un risque accru de tuberculose. Cela n’est pas surprenant, compte tenu de leur contact prolongé et souvent étroit avec les patients.16 Les médecins prenant en charge la tuberculose dans toutes ses formes (médecins internistes, pneumologues, infectiologues, urgentistes et réanimateurs) connaissent des taux importants d’infection tuberculeuse. Ces spécialistes ont des taux d’infection plus élevés que ceux des autres spécialités, probablement en raison du risque supplémentaire associé à la bronchoscopie ou aux soins des patients ventilés dans les unités de soins intensifs. Les anatomopathologistes et les médecins légistes représentent un autre groupe à risque. Une incidence élevée de tuberculose parmi les anatomopathologistes et les techniciens en pathologie a été rapportée par une étude au Japon. Les taux les plus élevés étant ceux qui ont pratiqué ou assisté à des autopsies.16
Bien que toutes les catégories suscitées présentent un risque de contracter l’infection, ce risque n’est pas le même compte tenu de leur statut immunitaire. En effet, l’infection par le VIH et la malnutrition ont montré leur rôle dans l’acquisition de la tuberculose mais aussi dans le passage de la TB latente vers la TB active. Dans le premier cas, on estime que les personnes VIH-positives sont 26 fois plus susceptibles de développer une tuberculose active que les personnes VIH-négatives.3 Ce risque accru est observable dès la séroconversion du VIH et s’aggrave encore lorsque la numération des lymphocytes T CD4+ diminue. Pour le second cas, il a été démontré qu’une mauvaise nutrition contribue à des carences protéino-énergétiques et en micronutriments, conduisant à une immunodéficience. Cette immunodéficience secondaire augmente la sensibilité de l’hôte à l’infection et augmente donc le risque de développer la tuberculose. La plupart des micronutriments ont des fonctions immunitaires : on en cite par exemple, la vitamine D qui est nécessaire à l’activation des macrophages, ce qui est essentiel pour maintenir la tuberculose en phase latente ; la vitamine A qui inhibe la multiplication des bacilles virulents dans les macrophages humains ; et le zinc qui joue un rôle important pour le macrophage au cours du processus de défense immunitaire.15
Le déficit en vitamine D chez les travailleurs de la santé a été objectivé dans plusieurs études. Ceci est attribué au travail de nuit et dans un environnement couvert, diminuant ainsi l’exposition au soleil. La mauvaise nutrition, quant à elle, conduit à une baisse de l’indice de masse corporelle (IMC) qui est fortement associé à la tuberculose.17, 18, 19, 20 On le démontre concrètement dans l’étude d’Essone et al., où le personnel de santé masculin avait un risque plus accru de TB maladie que leurs collègues femmes à cause de leurs IMCs. N’oublions pas également que le personnel de santé est à risque d’avoir des accidents exposant au sang et donc de contracter des virus à partir de matériel souillé de sang, y compris le VIH.21 On compte aujourd’hui 100 cas de transmission au travail du VIH chez le personnel de santé dans le monde depuis sa découverte.22 Ce faible taux est dû au fait qu’un accident exposant au sang s’associe à un risque de 0,23% de transmettre le VIH, ce qui est moindre en comparaison avec un risque de 6-30% pour l’hépatite B et de 1,8% pour l’hépatite C. Néanmoins, le risque y est et ne doit pas être négligé.23, 24
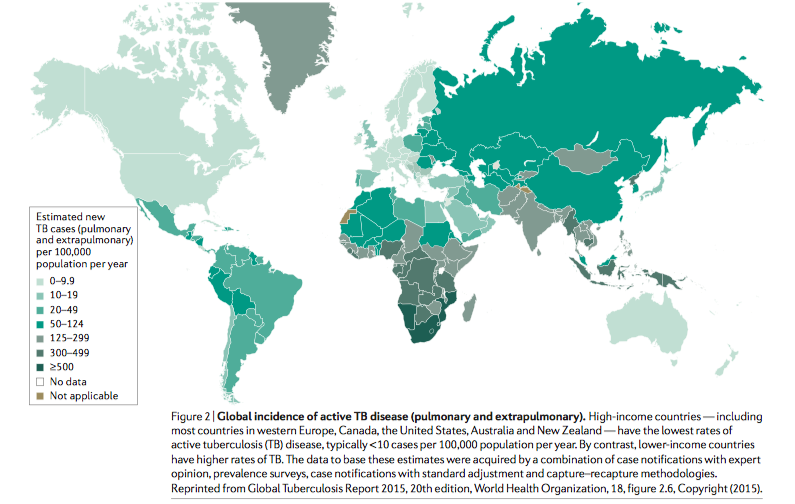
Tirée de : Global Tuberculosis Report 2015,20th edition, World Health Organization, 18, figure 2.6, copyright (2015).
La plupart des établissements de santé dans les pays à revenu faible ou intermédiaire (PRFI) manquent de ressources pour prévenir la transmission nosocomiale de la tuberculose alors que la présence de cette dernière est importante. Les raisons pour lesquelles ce problème devrait être abordé principalement dans ces pays (PRFI) sont que, premièrement, la tuberculose professionnelle peut entraîner la perte de travailleurs qualifiés, ce qui peut nuire aux services de santé à long terme. Deuxièmement, la transmission de la tuberculose peut avoir des conséquences graves, voire mortelles, pour les patients et les travailleurs de la santé. Cela est particulièrement vrai avec les souches de TB-MDR / XDR et dans les populations de patients à forte séroprévalence de VIH. En dernier lieu, la mise en œuvre d’un contrôle efficace de l’infection tuberculeuse peut promouvoir la sensibilisation à la tuberculose et l’adoption de meilleures pratiques pour le diagnostic et le traitement de celle-ci.29
La tuberculose latente un autre problème
Elle est caractérisée par la présence d’une réponse immunitaire à une infection à Mtb précédemment acquise sans qu’il y ait des manifestations cliniques de tuberculose active. C’est une phase où les Bacilles de Koch ne se multiplient pas de façon active, ils restent latents à l’intérieur des cellules. Par conséquent, les lésions histologiques ne sont pas installées et un traitement à cette phase préviendrait les conséquences désastreuses d’une tuberculose active.
Le problème qui se pose avec la tuberculose latente c’est que son diagnostic repose sur les tests immunologiques.
Il existe deux tests approuvés pour cette indication : l’intradermoréaction à la tuberculine (IDR) et l’IGRA (Interferon Gamma Release Assay, ou l’analyse de la libération de l’Intérféron Gamma). L’IGRA peut distinguer l’immunité induite par le BCG, de l’immunité induite par l’infection à Mtb.1
L’exposition au M. tuberculosis aboutit soit à l’élimination du BK soit à sa persistance. Dans le premier cas, M. tuberculosis est éliminé en raison des réponses immunitaires innées (dans ce cas, l’IDR à la tuberculine et l’IGRA peuvent être négatifs ou bien par une immunité adaptative cellulaire où l’IDR à la tuberculine et l’IGRA peuvent être positifs ou négatifs selon que les cellules T mémoires soient ou non mises en jeu). Cependant, si l’infection à M. tuberculosis n’est pas éliminée, l’agent pathogène peut persister dans un état de repos, c’est la tuberculose latente et l’individu développera généralement des résultats positifs pour l’IDR et l’IGRA. Dans d’autres cas, le bacille persiste dans un état actif, c’est la tuberculose maladie, qui regroupe un ensemble de manifestations cliniques liées à un foyer organique focal ou à une forme disséminée de la maladie. Dans ce cas aussi, les tests immunologiques seront positifs et le patient sera symptomatique.1
Pourquoi parlons-nous de la tuberculose latente (TL) dans notre article ? Tout simplement parce que la prévalence de cette dernière est élevée pour le personnel de santé ; ils ont donc un risque important de passer à une forme active. L’OMS recommande le traitement de cette forme chez eux, surtout s’ils travaillent dans les services où le taux de conversion des IDR à la tuberculine est élevé (services médicaux prenant en charge les malades tuberculeux connus ou non, notamment les services d’urgence).25, 26 Le traitement d’une TL peut protéger d’une activation de cette dernière jusqu’à 19 ans selon certaines cohortes.27
Le diagnostic de la TL se base sur des tests immunologiques. Ces derniers sont acceptables mais restent imparfaits, car aucun des deux tests ne peut différencier de façon précise entre une tuberculose latente et active, ni distinguer une réinfection d’une réactivation. Les deux tests ont une sensibilité diminuée chez les patients immunodéprimés et n’ont pas de valeur prédictive d’une progression vers une tuberculose active.28
Par exemple, devant une tuberculose active pauci-symptomatique avec des prélèvements microbiologiques négatifs, avoir un test immunologique positif peut nous mener à contre-pied. Une tuberculose active devant être traitée par une chimiothérapie antituberculeuse (classiquement l’association pendant 2 mois de RHZE en traitement d’attaque, puis une phase d’entretien associant RH pendant 4 mois ou plus selon la localisation) serait traitée par un ou deux antituberculeux pendant 3-9 mois si elle est considérée comme latente. Ceci est particulièrement dangereux car pouvant générer des résistances.
Les régimes thérapeutiques utilisés sont de 6 à 9 mois d’isoniazide ; 12 semaines de rifapentine plus isoniazide ; 3-4 mois d’isoniazide plus rifampicine ; ou 3-4 mois de rifampicine seule.
Étant donné les inconvénients représentés par la nocivité potentielle de ce traitement, la non-observance des patients et la défaillance des moyens de diagnostic pouvant différencier une tuberculose latente d’une tuberculose maladie, l’institution de ce traitement doit dès lors être le sujet d’une décision judicieuse et bien justifiée.
Comment peut-on lutter contre la tuberculose professionnelle
La mise en œuvre d’un programme bien organisé d’enquête et de contrôle des infections de la tuberculose dans les hôpitaux pourrait jouer un rôle important pour éviter la propagation des infections tuberculeuses et cela par des interventions relativement simples, telles que le diagnostic précoce de la tuberculose, l’isolement des patients atteints de tuberculose bacillifère, et l’éducation et la formation des travailleurs de la santé. D’autres mesures à faible coût pourraient inclure des contrôles techniques tels que la ventilation des services.29
Le CDC (Centers for Disease Control and Prevention) a récemment publié des lignes directrices mises à jour pour la prévention de la transmission de M. tuberculosis dans les établissements de santé. Ces lignes recommandent une approche pour améliorer le contrôle des infections à plusieurs niveaux : administratif, environnemental et personnel.13 Les stratégies administratives comprennent la réduction des délais de diagnostic en mettant en œuvre des tests de laboratoire avec un système de notification des résultats codifié et plus efficace, et en veillant à l’application des bonnes pratiques de protection. Concernant l’environnement, le CDC insiste sur la ventilation en mentionnant que la ventilation naturelle des services est plus efficace que la ventilation mécanique par aspiration. La protection individuelle est similaire à celle utilisée actuellement pour l’épidémie de Covid-19. Étant donné que ces deux pathogènes se transmettent par le biais de gouttelettes de Flügge, les mesures d’isolement et de protection respiratoire sont les mêmes pour les deux pathologies. Celles-ci comprennent l’utilisation régulière de masques respiratoires, avec un système de surveillance à l’échelle de l’établissement qui encourage l’utilisation routinière des matériels de protection.30
De plus, tous les Travilleurs de la Santé devraient participer à un dépistage obligatoire et régulier de la tuberculose. Un dépistage confidentiel du VIH devrait aussi être proposé à tout le personnel ; ceux qui sont VIH-positifs devraient avoir un accès immédiat et facilité au traitement et être placés dans des zones cliniques à faible risque de tuberculose.
Conclusion
Durant ce fléau sanitaire causé par la pandémie du Covid-19, les vulnérabilités du système de santé ont été exposées, et ce, à travers le monde entier. La tuberculose, qui est la première cause de décès par un agent infectieux, s’est faite estompée par cette pathologie. Néanmoins, la valeur du personnel de santé rayonne plus que jamais. insi, nous profitons de cette occasion pour insister sur l’importance de cette pathologie oubliée chez les porteurs de blouses blanches qui peuvent eux-mêmes devenir porteurs de caséum. Dans ces cas-là, où le soignant doit être soigné, on a l’impression d’avoir été infiltré par l’ennemi, et quel ennemi ! Car il leurre notre compréhension depuis des siècles et, à ce jour, seule la conception d’un vaccin efficace semble être la solution idoine. En attendant cette découverte, la prévention individuelle et collective dans les milieux de soins doit impérativement être instituée de façon rigoureuse pour protéger nos soldats aux tenues blanches.
Références
1- Pai M, Behr M, Dowdy D, Dheda K, Divangahi M, Boehme C et al. Tuberculosis. Nature Reviews Disease Primers. 2016;2(1).
2- World Health Organization. Global Tuberculosis Report 2019 (WHO , 2019).
3- World Health Organization. Global Tuberculosis Report 2015 (WHO, 2015).
4- Tuberculose: profils de pays [Internet]. Organisation mondiale de la Santé. 2018 [cited 21 April 2020]. Available from here.
5- CMIT. Tuberculose. In E.PILLY 27e Edition : ALINÉA Plus Ed ; 2020: pp 397-403.
6- Bennett J, Dolin R, Blaser M, Douglas R, Mandell G. Mandell, Douglas, and Bennett’s principles and practice of infectious diseases. Philadelphia: Elsevier; 2020.
7- Li H, Wang X, Wang B, Fu L, Liu G, Lu Y et al. Latently and uninfected healthcare workers exposed to TB make protective antibodies against Mycobacterium tuberculosis. Proceedings of the National Academy of Sciences. 2017;114(19):5023-5028.
8- Saini D, Hopkins G, Seay S, Chen C, Perley C, Click E et al. Ultra-low dose of Mycobacterium tuberculosis aerosol creates partial infection in mice. Tuberculosis. 2012;92(2):160-165.
9- Owen J, Punt J, Stranford S, Kuby J. Kuby immunology. New York: W.H. Freemann; 2013.
10- Li H, Wang X, Wang B, Fu L, Liu G, Lu Y et al. Latently and uninfected healthcare workers exposed to TB make protective antibodies against Mycobacterium tuberculosis. Proceedings of the National Academy of Sciences. 2017;114(19):5023-5028.
11- McLean M, Lu L, Kent S, Chung A. An Inflammatory Story: Antibodies in Tuberculosis Comorbidities. Frontiers in Immunology. 2019;10.
12- Abebe F. Synergy between Th1 and Th2 responses during Mycobacterium tuberculosis infection: A review of current understanding. International Reviews of Immunology. 2019;38(4):172-179.
13- Sharma D, Sharma J, Deo N, Bisht D. Prevalence and risk factors of tuberculosis in developing countries through health care workers. Microbial Pathogenesis. 2018;124:279-283.
14- von Delft A, Dramowski A, Khosa C, Kotze K, Lederer P, Mosidi T et al. Why healthcare workers are sick of TB. International Journal of Infectious Diseases. 2015;32:147-151.
15- Kant S, Gupta H, Ahluwalia S. Significance of Nutrition in Pulmonary Tuberculosis. Critical Reviews in Food Science and Nutrition. 2015;55(7):955-963.
16- 91. Harries AD, Maher D, Nunn P. Practical and affordable measures for the protection of health care workers from tuberculosis in low-income countries. Bull World Health Organ. 1997;75(5):477–489.
17- Weber D, Rutala W. Occupational Health Update. Infectious Disease Clinics of North America. 2016;30(3):729-757.
18- Dogruel F, Gonen Z, Canpolat D, Ocak H, Bayram F. Investigation of Vitamin D levels in medical staff in a dental clinic. Nigerian Journal of Clinical Practice. 2019;22(4):573.
19- Sowah D, Fan X, Dennett L, Hagtvedt R, Straube S. Vitamin D levels and deficiency with different occupations: a systematic review. BMC Public Health. 2017;17(1).
20- Khan AU, Hossain MA, Rahman MA, Rahman HW, Reza MA, Khan MK, Mahmud AA. Estimation of Vitamin D levels among Physicians Working in a Tertiary Level Hospital of Bangladesh. Mymensingh Med J. 2019 Apr;28(2):322-327. Accessed from: https://www.ncbi.nlm.nih.gov/pubmed/31086146.
21- Occupational exposures to blood [Internet]. Cdc.gov. 2020 [cited 21 April 2020]. Available from: https://www.cdc.gov/hai/pdfs/bbp/exp_to_blood.pdf .
22- Elseviers M, Arias-Guillén M, Gorke A, Arens H. SHARPS INJURIES AMONGST HEALTHCARE WORKERS: REVIEW OF INCIDENCE, TRANSMISSIONS AND COSTS. Journal of Renal Care. 2014;40(3):150-156.
23- Baggaley R, Boily M, White R, Alary M. Risk of HIV-1 transmission for parenteral exposure and blood transfusion: a systematic review and meta-analysis. AIDS. 2006;20(6):805-812.
24- Needlestick injuries, discarded needles and the risk of HIV transmission. (2020). Retrieved 20 April 2020, from here.
25- Getahun H, Matteelli A, Abubakar I, Aziz M, Baddeley A, Barreira D et al. Management of latent Mycobacterium tuberculosis infection: WHO guidelines for low tuberculosis burden countries. European Respiratory Journal. 2015;46(6):1563-1576.
26- Nasreen S, Shokoohi M, Malvankar-Mehta M. Prevalence of Latent Tuberculosis among Health Care Workers in High Burden Countries: A Systematic Review and Meta-Analysis. PLOS ONE. 2016;11(10):e0164034.
27- Comstock GW, Baum C, Snider DE Jr. Isoniazid prophylaxis among Alaskan Eskimos: a final report of the bethel isoniazid studies. Am Rev Respir Dis 1979;119:827–30.
28- Pai M, Denkinger C, Kik S, Rangaka M, Zwerling A, Oxlade O et al. Gamma Interferon Release Assays for Detection of Mycobacterium tuberculosis Infection. Clinical Microbiology Reviews. 2014;27(1):3-20.
29- Joshi R, Reingold A, Menzies D, Pai M. Tuberculosis among Health-Care Workers in Low- and Middle-Income Countries: A Systematic Review. PLoS Medicine. 2006;3(12):e494.
30- Afir Y, Guerboukha N. Covid-19 – Revue de la Littérature Scientifique & Consignes pour le Personnel de Santé. Medpress. 2020;4.