To Vaccinate or Not To Vaccinate?
Nazih Mohamed Zakari KOUIDRAT & Thinhinane SARI
De nos jours, ce ne sont plus uniquement les enfants malades qui consultent chez le médecin mais également ceux en bonne santé, pour être protégés contre des maladies qu’ils n’ont pas. L’eldorado de l’industrie pharmaceutique ne serait-il pas de soigner des personnes saines ? Si on ajoute que ces maladies, bien que dangereuses, sont souvent rares ou inconnues, on obtient une substance qui concentre tout ce qu’il faut pour alimenter les controverses les plus virulentes. Dans ce présent article, il sera question de soulever les principales polémiques suscitées par la vaccination et relater le plus fidèlement possible la matière scientifique qui leur est inhérente. Il ne s’agit d’aucune manière d’une tentative d’influencer le lecteur, tant nous croyons à la liberté comme acte de la pensée.
Introduction
Le plus grand succès de la vaccination a eu lieu quand la variole fut déclarée éradiquée, en 1980. En effet entre 1880 et 1980, on estime qu’elle a causé la mort de près de 500 000 personnes. La poliomyélite est maintenant la deuxième maladie humaine susceptible d’être éradiquée dans le monde. Seulement 3 et 10 cas de poliomyélite ont été signalés respectivement au Pakistan et Afghanistan au cours du premier semestre de 2018.1
Malgré ces résultats, l’histoire de la vaccination est minée de polémiques notamment à cause des Manifestations Postvaccinales Indésirables (MAPI).
Les MAPI peuvent soit être causées par les vaccins, soit survenir après une vaccination par hasard. Lorsqu’un lien de causalité avec un vaccin existe, les MAPI sont le plus souvent temporellement liées à la vaccination, c’est-à-dire apparaissant peu de temps après une injection, et plus rarement, elles surviennent à distance. Toutefois, la temporalité ne peut en aucun cas être considérée comme une preuve de causalité.2
A. Manifestations Indésirables Neurologiques
– Convulsions fébriles :
L’inoculation du vaccin DTC (Diphtérie Tétanos Coqueluche) dont le composé Coqueluche est à cellules entières, est associé à un risque accru de convulsions fébriles (CF), uniquement le jour de la vaccination (risque relatif ajusté, 5.70). De même, l’inoculation du vaccin ROR (Rougeole Oreillons Rubéole) est associée à un risque élevé de CF 8 à 14 jours après la vaccination (risque relatif, 2.83).
Le nombre de CF attribuables aux vaccins DTC et ROR est estimé respectivement à 6 à 9 et à 25 à 34 cas pour 100 000 enfants. Même si le composé C du DTC est en cours de remplacement par un composé acellulaire, l’actuel DTC et le ROR ont permis de réduire l’incidence des séquelles neurologiques résultant de la coqueluche et de la rougeole. De plus, les enfants ayant présenté des CF n’ont pas montré de risque plus élevé de crises ultérieures ou de troubles neurologiques.3
Une autre étude a également retrouvé que le risque de CF augmente lorsqu’on utilise le ROR et l’anti-Varicelle ensemble (ROR-V) à la première dose chez les enfants de moins de 4 ans, bien que le risque absolu reste faible (1 pour 3 000 à 4 000 doses). Dans plusieurs études, le ROR-V était associé à un risque deux fois plus élevé de CF 1 à 2 semaines après la vaccination par rapport à des injections séparées de ROR et de varicelle. Aussi, ni le ROR-V simultanés, ni les injections séparées de ROR et d’anti-Varicelle n’étaient associés à un risque accru de CF entre 4 et 6 ans.4
Il y a lieu de relever que, quelle que soit la cause de la fièvre, le jeune âge est en soi un facteur de risque de CF. Rappelons que les CF sans complications survenant après une vaccination ne constituent en aucune façon une contre-indication à de futures vaccinations.
– Encéphalopathies :
Ce sont des lésions inflammatoires démyélinisantes du système nerveux central. Plusieurs vaccins ont été accusés de liens de causalité avec des encéphalopathies. Nous en citons les principaux :
Vaccin contre la coqueluche (anti Bordetella pertussis) :
L’encéphalopathie post-vaccin anti-coquelucheux est une complication rare mais bien connue, survenant le plus souvent chez le nourrisson.5
Les résultats concernant le lien de causalité restent contradictoires. Initialement, l’étude National Childhood Encephalopathy Study (NCES), menée au Royaume-Uni de 1976 à 1979, a suggéré la possibilité d’une relation entre le vaccin DTC et l’encéphalopathie chez un petit nombre d’enfants, à raison de 1 sur 310 000 doses. Cependant, on opposa à cette étude ses faiblesses méthodologiques et ses résultats non corroborés par des études ultérieures menées au Royaume-Uni, au Danemark et au Tennessee.2
Plus tard, ce fut le composé C (vaccin à cellules entières) du DTC qui fut considéré comme le plus réactogène. Un nouveau vaccin acellulaire composé d’Hémagglutinine Filamenteuse (HAF), entre autres, a été mis au point au Japon, qui donnerait moins de réactions indésirables.6
L’encéphalopathie survenant après les vaccins acellulaires reste très rare, 7 cas ont été rapportés au Canada entre 1993 et 2002, sans que la causalité ne soit établie.7
Il est à noter qu’il existe généralement d’autres explications aux encéphalopathies post-vaccinales. Néanmoins, si aucune cause n’est décelée dans les 7 jours, les futures vaccinations contenant la coqueluche sont contrindiquées.
Enfin, il a été démontré qu’un syndrome épileptique grave (syndrome de Dravet), dû à des mutations du gène du canal sodique (SCN1A), était responsable de certains cas d’encéphalopathie que l’on croyait causés auparavant par des vaccins anticoquelucheux. En effet, les nourrissons/enfants ayant certaines anomalies génétiques peuvent exprimer les symptômes de leur maladie après contact avec un déclencheur non spécifique (fièvre, stress, vaccination).8
ROR :
Une augmentation du risque de méningite aseptique a été observée suite à la vaccination par le ROR. Il s’agissait principalement des souches vaccinales Urabe-oreillons et Leningrad-Zagreb. Toutefois, la souche Jeryl Lynn, utilisée aux Etats-Unis, n’a pas été associée à ce risque.9, 10, 55
Plus grave encore, on a pointé du doigt le risque de survenue de Panencéphalite Sclérosante Subaiguë (PESS) après l’administration du vaccin antirougeoleux. Cette infection cérébrale peut être causée naturellement par le virus de la rougeole et entraîner des déficiences physique et mentale graves puis la mort. Les symptômes apparaissent généralement des années après les premières infections par la rougeole.
Cependant, ces suspicions ne tenaient pas la route, car après l’introduction de la vaccination antirougeoleuse aux États-Unis, le nombre de cas de PESS est passé de 40-50 cas par an à 1 ou 2 par an. De plus, l’analyse des virus de la rougeole dans le cerveau des patients atteints de PESS a montré qu’ils étaient du même type que celui associé à l’épidémie de rougeole, et la présence du virus vaccinal n’a jamais été démontrée.2
– Le Syndrome de Guillain–Barré :
Vaccin antigrippal :
Devant le risque pandémique de la grippe porcine en 1976-1977 aux USA, le gouvernement a lancé une compagne nationale de vaccination contre celle-ci. C’est alors qu’il a été constaté que le syndrome de Guillain-Barré (SGB) s’était développé chez 1/100 000 vaccinés (5 à 10 fois le taux de base), ce qui avait conduit à la suspension du vaccin.
En 2009, un virus grippal A (H1N1) a été identifié et s’est rapidement répandu dans le monde entier. On s’est de nouveau intéressé au risque de SBG lié au vaccin développé contre ce nouveau virus. Une étude internationale menée entre 2009 et 2010 dans 5 pays (Danemark, France, Pays-Bas, Suède et Royaume-Uni) a conclu à l’absence de corrélation entre le vaccin et le SGB. Elle a révélé que le risque absolu, basé sur la limite supérieure de l’intervalle de confiance, de 2.7, serait inférieur à 3 cas de SGB supplémentaires par million de vaccinations. Une étude similaire a été menée aux Etats-Unis, également entre 2009 et 2010. Il en est résulté à 0.8 cas supplémentaires de SGB par million chez les personnes vaccinées, chiffre semblable à celui observé avec les vaccins antigrippaux saisonniers.2
Plus tard, des études menées au fil des ans ont également montré un risque accru de SGB après une grippe saisonnière, et son ampleur est plusieurs fois supérieure à celle qui suit la vaccination antigrippale, suggérant que la vaccination pourrait protéger contre le SGB en diminuant les infections grippales.11
Enfin, pour mieux entretenir le débat, une revue systématique et une méta-analyse ont été réalisées sur 39 études entre 1981 et 2014. Les résultats suggèrent une association faible mais statistiquement significative entre les vaccins antigrippaux, en particulier ceux contre la grippe pandémique, et le SGB (RR = 1.84 pour les vaccins pandémiques vs RR = 1.22 pour le vaccin saisonnier).12
Vaccin antirabique :
Un risque élevé de SGB a été lié à deux vaccins : le vaccin « Semple », produit sur cerveau de mouton ou de chèvre matures, et le vaccin SMB (Suckling Mouse Brain) produit sur cerveau de souriceau nouveau-né. On a attribué ces effets à la présence de protéines cérébrales dans le vaccin avec génération d’auto-anticorps à réactivité croisée avec les tissus neuraux. Suite à cela, ces vaccins ont été suspendus en 1980 aux USA. Les nouvelles formulations de vaccin, dérivées de cellules d’embryons de poulet, ne semblent pas être associées de manière causale au SGB.13
– La Poliomyélite Paralytique Associée au Vaccin :
À l’échelle mondiale, la poliomyélite a été éliminée dans la majorité des pays, et ceci principalement grâce au vaccin antipolio, sous forme orale (VPO). Ce dernier utilise un virus vivant atténué et peut l’excréter pendant plusieurs semaines, et les destinataires ou contacts du VPO peuvent être infectés par le virus. La plupart des personnes vaccinées ne présentent aucun effet indésirable. Malgré cela, une complication sérieuse du VPO a été décrite : la Poliomyélite Paralytique Associée au Vaccin (PPAV), qui est cliniquement aussi grave que la maladie due au virus sauvage. Elle reste rare, avec en moyenne 4 à 6 cas/an dans le monde, ou 1 cas/2,4 millions de doses.
Cependant, en l’absence de cas de polio dans de nombreuses régions du monde, même ce risque très faible devient significatif. En conséquence, les USA et d’autres pays occidentaux ont opté pour l’utilisation exclusive du vaccin antipoliomyélitique inactivé, par voie injectable (VPI). Depuis lors, les cas de PPAV aux USA ne sont que des cas importés par des voyageurs revenant de pays utilisant encore le VPO.
A noter que l’Algérie aussi se prépare à remplacer le VPO par le VPI lors du prochain calendrier vaccinal.
B. Troubles du Spectre Autistique
Il est admis que le nombre de cas d’autisme est en augmentation sans que l’on sache si cela est dû à une augmentation effective des syndromes autistiques, à une surveillance plus étroite, une sensibilisation plus grande ou encore à l’élargissement de la définition des Troubles du Spectre Autistique (TSA). Les vaccins n’ont pas tardé à concentrer toutes les suspicions, en raison de la coïncidence de l’âge moyen d’apparition de l’autisme (18-19 mois) avec l’âge de l’administration du vaccin ROR.1
– ROR et Autisme, le début de la controverse :
Le Dr Andrew Wakefield et ses collègues ont publié un article dans The Lancet décrivant l’association d’anomalies gastro-intestinales et de troubles du développement chez 12 enfants.14 Plus tard, ils ont rapporté, dans une étude faite au Japon, que des fragments d’ARN du virus de la rougeole avaient été retrouvés dans les globules blancs d’un patient parmi 8 atteints de la maladie de Crohn, 1 patient parmi 3 atteints de colite ulcéreuse et 3 patients parmi 9 atteints d’autisme. Les témoins étaient tous négatifs, confirmant ainsi leur théorie « d’Entérocolite autistique ».15
Peu de temps après son apparition, les limites scientifiques du document publié par Wakefield & al. ont été mises en évidence, par exemple la conclusion selon laquelle l’autisme était une conséquence de l’inflammation gastro-intestinale, alors que les symptômes gastro-intestinaux avaient été observés après, pas avant, les signes.16 De plus, 3 des enfants n’avaient pas réellement de TSA et 5 avaient des problèmes neuro-développementaux avant la vaccination.17 Par la suite, plusieurs études de grande envergure (Madsen & al. (Danmark), Taylor & al. (GB), Black & al. (USA) et Honda & al. (Japon)) ont été effectuées ne révélant aucun lien entre le vaccin ROR et l’autisme.2
La causalité physiopathologique était loin d’être établie. Un rapport a comparé la présence du virus de la rougeole dans les tissus intestinaux de 91 enfants présentant des troubles du développement, y compris les TSA, et de 70 témoins. La persistance du virus au niveau des tissus intestinaux était plus fréquente chez les enfants présentant des troubles du développement (82% vs 7%). Bien que les auteurs aient conclu que les résultats confirment une association entre la persistance du virus de la rougeole et la pathologie intestinale chez les enfants atteints de troubles du développement, l’étude et ses conclusions ont été critiquées pour leurs défauts méthodologiques, par exemple l’absence de précision sur la nature du virus détecté, sauvage ou vaccinal ainsi que le manque d’information sur le fait que les témoins aient reçu ou non le vaccin ROR.
Bien que le virus de la rougeole ait été détecté dans des échantillons intestinaux ou de sang d’enfants atteints de TSA, des études ultérieures utilisant des dosages très sensibles et spécifiques et des techniques de laboratoire améliorées n’ont pas permis de détecter les acides nucléiques du virus de la rougeole dans les globules blancs des enfants atteints de TSA qui avaient reçu le vaccin ROR.17, 18
D’autres études épidémiologiques ont comparé le risque de développer des TSA entre les enfants ayant reçu le ROR et ceux qui ne l’ont pas reçu. Aucune association n’a été détectée entre le vaccin ROR et les TSA.19
Forcés de reconnaître qu’aucun lien de causalité n’était établi entre le vaccin ROR et l’autisme, 10 des coauteurs du document de Wakefield demandèrent de rétracter formellement l’interprétation de leur rapport.1
Ces éléments troublants jetèrent la suspicion sur l’étude originale, et notamment sur le premier auteur, Andrew Wakefield. En effet, sur un papier publié dans le British Medical Journal, Brian Deer, journaliste d’investigation, soutenait que le document initial de Wakefield & al. était un « ensemble complexe de fraude », car l’auteur aurait modifié de nombreux faits sur les antécédents médicaux de ses patients afin de soutenir sa prétention d’avoir identifié un nouveau syndrome. La responsabilité des données falsifiées a été imputée sans équivoque à Wakefield2 et l’enquête a finalement amené The Lancet à déclarer la recherche frauduleuse et à la retirer.17
Notons qu’en 2017, Vera Sharav, présidente de Alliance for Human Research Protection, a publié un article affirmant que les conclusions de Deer, qui avaient conduit à la perte de la licence médicale de Wakefield au Royaume-Uni, étaient complètement fausses, sans fondement et qu’il fut injustement ciblé !1
Revenons à la science maintenant. Les résultats des différentes études tendent vers l’absence de lien de causalité entre le vaccin ROR et les TSA ; c’est aussi l’avis de l’Immunization Safety Review Committee. Le Comité note toutefois que sa conclusion n’exclut pas la possibilité que le vaccin ROR contribue aux TSA chez un petit nombre d’enfants, car les preuves épidémiologiques, bien que loin d’être établies, ne sont pas réfutées.56
– Le Thimérosal :
Il s’agit d’un additif ajouté à certains vaccins pour garantir leur stérilité. Le thimérosal contient 49,6% de mercure et se métabolise en éthylmercure et en thiosalicylate. Vers la fin du XXe siècle, L’Environmental Protection Agency (EPA) a publié des normes relatives aux limites de sécurité de l’exposition orale au méthylmercure, indiquant que les américains sont principalement exposés au méthylmercure organique, en consommant du poisson et des coquillages qui en contiennent.
Il est important de noter que les différentes recommandations pour le mercure étaient basées sur des études sur le méthylmercure, alors que le thimérosal, tel que mentionné précédemment, est un dérivé de l’éthylmercure. Celui-ci étant moins neurotoxique et éliminé plus rapidement que le méthylmercure. Ainsi, l’extrapolation des risques du methylmercure sur l’éthylmecrure semble être inadéquate.20
L’exposition maximale au mercure contenu dans les vaccins se situerait dans les limites acceptables fixées par la FDA, l’ATSDR et l’OMS. Cependant, selon le poids du nourrisson et le choix des formulations de vaccins, certains nourrissons pourraient avoir été exposés à des concentrations cumulatives, lors de consultations multiples, dépassant les recommandations de l’EPA.
Se basant sur ces préoccupations purement théoriques mais biologiquement plausibles, l’US Public Health Service et l’American Academy of Pediatrics, ont publié deux déclarations conjointes en 1999, appelant les fabricants de vaccins à réduire ou à éliminer le thimérosal par mesure de précaution.
Sur le plan clinique, l’intoxication au mercure se manifeste chez les enfants par des modifications caractéristiques motrices, visuelles, verbales, psychiatriques et du périmètre crânien qui sont fondamentalement différentes de celles des enfants autistes. Par ailleurs, l’existence d’effets neuro-développementaux a été démontrée pour les expositions prénatales à de faibles doses de méthylmercure, mais pas pour les expositions postnatales.20
Des études menées aux îles Féroé font état de déficits cognitifs subtils et à long terme à des niveaux de méthylmercure que l’on pensait auparavant sans danger. Cependant, les enfants de ces îles pourraient avoir été exposés à d’autres toxines (par exemple, les biphényles polychlorés). Des études sur des enfants des Seychelles, n’ont pas permis de mettre en évidence des effets cognitifs ou comportementaux significatifs chez les enfants de femmes consommant beaucoup de poisson lorsque d’autres facteurs, tels que les modificateurs du développement social et environnemental et l’exposition postnatale au mercure, ont été pris en compte.17
Les résultats des études restent contradictoires entre l’association entre le thimérosal et les TSA. D’un côté, malgré l’élimination du thimérosal dans les vaccins en Suède et au Danemark, l’incidence de l’autisme a continué d’augmenter2, 17, 21 de même que les études évaluant les niveaux de mercure dans les cheveux, l’urine ou le sang d’enfants atteints de TSA par rapport aux témoins ont des résultats incohérents.17, 22, 23 De plus, les preuves que la thérapie par chélation du mércure améliore les TSA font défaut.17
D’un autre côté, un certain nombre d’études récentes, tout en affirmant l’importance de la vaccination, appelle à l’élimination du thimérosal car pouvant être lié à des troubles neuro-développementaux24-26, en particulier les tics.27
C. L’hypersensibilité :
Les allergènes potentiels dans les vaccins comprennent des composants de l’agent infectieux, mais plus probablement des excipients (antibiotiques ou stabilisants) ou des résidus du processus de fabrication comme les produits de milieux de culture (œufs, cellules de rein de singe).
– L’anaphylaxie :
C’est une réaction d’hypersensibilité médiée par les IgE de type I, la plus grave parmi les MAPI. Selon l’IOM (Institut Of Medicine), les preuves soutiennent de manière convaincante une relation causale entre l’anaphylaxie et le ROR, le vaccin contre l’hépatite B (chez les sujets sensibles à la levure), les anatoxines de la diphtérie ou du tétanos, ainsi que les vaccins contre la varicelle, l’influenza et le méningocoque. Les preuves plaident également en faveur d’un lien de causalité avec le vaccin anti-HPV. L’anaphylaxie provoquée par la vaccination est une contre-indication à d’autres doses du vaccin qui l’a provoquée.1, 2
Les antibiotiques :
En raison de la faible quantité d’antibiotiques contenue dans les vaccins, il est généralement peu probable que ces injections provoquent des réactions d’hypersensibilité systémiques. Malgré leur rareté, les patients présentant des réactions anaphylactiques à la néomycine topique ou systémique ne doivent pas être vaccinés avec des vaccins contenant de la néomycine.28 La néomycine topique est connue pour causer une dermatite de contact, mais il n’a pas été démontré que la quantité contenue dans les vaccins était suffisante pour provoquer des réactions d’hypersensibilité de type retardé.2
Les sels d’aluminium :
Les adjuvants à base d’aluminium sont de puissants stimulateurs du système immunitaire. Cependant, certaines données suggèrent un lien entre l’exposition à de grandes quantités d’aluminium par les aliments et l’eau potable et le développement de troubles neurologiques graves, notamment la maladie d’Alzheimer.29, 30 Il faut quand même rappeler que c’est un élément omniprésent auquel sont exposés les nourrissons en permanence. Les directives de l’Agency for Toxic Substances and Disease Registry suggèrent que la quantité d’aluminium sans danger pour les nourrissons est de 1 mg/kg/jour.31
Le syndrome myofasciite macrophagique (myalgies, arthralgies et fatigue) a été associé à des vaccins avec adjuvant en aluminium. Les biopsies musculaires suivies par l’étude microscopique montrent la présence d’inclusions d’hydroxyde d’aluminium dans les lésions et dans le cytoplasme des macrophages. Cette réaction est considérée par certains comme une réponse immunitaire normale à l’adjuvant d’aluminium.32, 33 Une revue de la littérature publiée en 2016, affirme que l’aluminium ne causerait aucun effet secondaire grave et justifie son utilisation dans les vaccins.34 D’autres études et revues de la littérature ont suggéré des effets neurologiques potentiels de la persistance de l’aluminium au long cours chez certains individus prédisposés, par défaut de clearance. En effet, chez ces derniers, la persistance de l’aluminium peut causer une myofasciite et dans certains cas, des effets neurologiques délétères après phagocytose par les macrophages puis transport au niveau du cerveau.35-38 Néanmoins, des recherches supplémentaires sont nécessaires pour étudier l’effet au long cours de l’aluminium.
Les protéines :
L’allergie aux œufs est la plus connue des allergies vaccinales. Elle ne constitue cependant pas une contre-indication à de futures vaccinations.39 La majorité des allergies menaçant le pronostic vital est probablement due à la gélatine contenue dans les vaccins, avec une incidence d’anaphylaxie très élevée en raison de susceptibilités génétiques. Si des enfants présentent des antécédents allergiques à la gélatine, il est recommandé de discuter avec un allergologue ou un immunologiste avant la vaccination.1, 2, 17
– La maladie atopique
Certains vaccins ont été associés à une augmentation de l’incidence de la maladie atopique. Parmi les plus emblématiques, le DTC (Diphtérie – Tétanos – Coqueluche), qui serait associé à l’asthme selon une étude prospective cohorte néozélandaise menée en 1997. Dans cette étude, l’asthme s’est développé chez plus de 20% des 1184 enfants vaccinés, âgés entre 11 et 16 ans. Certains ont émis l’hypothèse que la tendance à l’atopie réside dans la propension à augmenter la production d’IgE après les infections naturelles à la coqueluche et éventuellement après la vaccination contre la coqueluche.2, 40, 41 D’autres études plus récentes, ont réfuté ce lien en indiquant certains biais méthodologiques et en affirmant que le vaccin DTC n’augmentait pas le risque d’asthme ou d’atopie.42, 43, 44 Dans une revue de la littérature publiée en 2018, il a été conclu qu’il n’y avait aucune corrélation entre la vaccination et le risque d’atopie.45
En ce qui concerne le ROR, les différentes études n’ont démontré aucune augmentation du risque d’atopie.44, 45 Bien au contraire, dans une étude observationnelle aux Îles Féroé, 640 enfants ont été suivis dès la naissance et examinés à l’âge de 5, 7 et 13 ans. Il a été constaté que le vaccin aurait une tendance à la réduction du risque d’atopie.46
Enfin, au sujet de la grippe, qui a longtemps été impliquée en tant que déclencheur de crises d’asthme, une revue systémique et une méta-analyse impliquant la recherche dans 12 bases de données internationales d’essais contrôlés randomisés (1970-2016) a révélé que la vaccination antigrippale protégeait contre les infections virales ainsi que la récurrence des crises d’asthme.47
D. Vaccins et Cancer
– Le formaldéhyde
Il s’agit d’une substance utilisée afin de garantir la stérilité du vaccin. Tous les êtres humains ont du formaldéhyde détectable dans leur circulation, car il constitue un intermédiaire essentiel du métabolisme humain. A des concentrations élevées, il peut endommager l’ADN et provoquer des modifications cancéreuses in vitro.2 Aussi, des quantités résiduelles de formaldéhyde après fabrication peuvent être décelées dans plusieurs vaccins actuels sans dépasser 0.1 mg par dose.2, 48, 49 Cela dit, la quantité de formaldéhyde présente naturellement chez un nourrisson de 5 kg serait de 1,1 mg, soit 10 fois la quantité contenue dans les vaccins. Le formaldéhyde ne semble pas être une cause de cancer chez l’homme et chez les modèles animaux exposés à de grandes quantités.2, 48
– Contamination des vaccins
Entre 1955 et 1963, pas moins de 100 millions d’Américains ont pu être exposés au virus simien 40 (SV40) qui avait contaminé le vaccin antipolio inactivé (VPI). En 1961, il a été constaté que le SV40 provoquait des tumeurs chez les rongeurs.2 Le SV40 peut aussi transformer des cellules humaines en cellules de type malin.50 Une grande étude menée en Suède a examiné les taux de cancer chez 700 000 personnes qui avaient reçu le vaccin potentiellement contaminé par la polio jusqu’en 1957 ; ne révélant aucune augmentation de l’incidence du cancer.2 En 1998, le National Cancer Institute a entrepris une vaste étude qui a révélé qu’il n’y avait pas d’incidence accrue de cancer chez les personnes susceptibles d’avoir reçu un vaccin contenant du SV40.51, 52
Enfin, des revues de la littérature ont émis la même conclusion, en appelant toutefois à la réalisation de nouvelles recherches biologiques et épidémiologiques afin de corroborer ces résultats.51, 53
E. Vaccins et auto-immunité
L’IOM a validé des associations liées aux vaccins contre la toxine diphtérique, la polio et la rougeole avec le syndrome de Guillain-Barré ; le vaccin ROR avec le purpura thrombopénique immunologique ; la rubéole avec l’arthrite chronique.
A l’opposé des réactions auto-immunes liées à une infection, celles liées aux vaccins ont généralement une évolution plus légère et spontanément résolutive et une incidence plus faible (beaucoup moins que 1/10000). De ce fait, le bénéfice de la vaccination dépasse largement ses effets secondaires.2
F. Vaccins et affaiblissement du système immunitaire
Une théorie selon laquelle les vaccins submergeraient le système immunitaire a été rendue populaire lorsqu’une fillette de 9 ans présentant un déficit en enzyme mitochondriale et dont l’encéphalopathie, qui comprenait des caractéristiques des TSA, avait empiré après la réception de vaccins multiples à l’âge de 19 mois. Cette théorie a été d’autant plus accréditée par le fait que sa famille ait reçu une indemnisation dans le cadre du programme américain d’Indemnisation des Traumatismes liés Aux Vaccins (VICP). Cette démarche n’a pas manqué d’alimenter la théorie selon laquelle l’administration simultanée de plusieurs vaccins peut déclencher l’autisme.2
Néanmoins, ceci ne tient pas la route car, comme le notent Kennedy et Lawrence, un nouveau-né rencontre une vaste gamme d’antigènes pendant et immédiatement après la naissance, et la quantité d’antigènes vaccinaux est infiniment petite comparée à celle rencontrée dans l’environnement. Aussi, il a été démontré que les associations de vaccins induisent des réponses immunitaires comparables à celles données individuellement.2
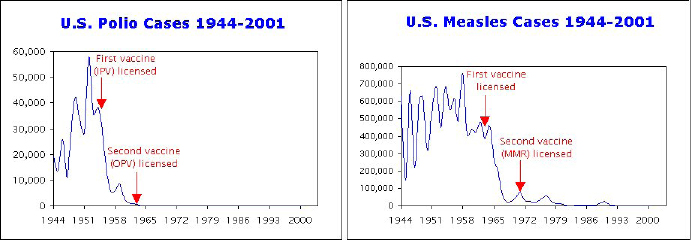
Image tirée du site http://drwile.com/lnkpages/render.asp?vac_effective#r2
G. Un problème de communication ou de confiance ?
La vaccination a contribué à la baisse significative de la morbi-mortalité de 9 maladies évitables entre 1900 et 1999 aux États-Unis.2 Ainsi, l’éradication mondiale de la variole fut déclarée en 1979 et la Rubéole fut annoncée comme éliminée aux USA en 2005.
Victime de son succès, la vaccination a fait oublier aux parents les taux élevés de morbi-mortalité des maladies contrôlées. Certains ont même l’impression que la vaccination présente un risque plus élevé pour leurs enfants que les maladies elles-mêmes. Une partie des parents considère que la nécessité de vacciner les enfants pour pouvoir participer au système scolaire public constitue une invasion par le gouvernement dans leurs décisions. Sauf que les parents qui retardent ou refusent les vaccinations mettent en danger non seulement leurs enfants, mais également ceux des autres et les immunodéprimés. Une maladie comme la varicelle, souvent bénigne chez des personnes en bonne santé, peut être fatale pour les personnes dont le système immunitaire est affaibli. Même si un vaccin n’est pas efficace à 100%, il peut réduire la gravité de la maladie.
D’autres sceptiques affirment que l’accès à une eau salubre, une meilleure nutrition et au progrès médical ont contribué au déclin des maladies contagieuses. Néanmoins, si ces changements en étaient la seule raison, la réduction aurait été simultanée et progressive pour de nombreuses maladies au cours de la même période. Au lieu de cela, les statistiques montrent que ces maladies ont été réduites indépendamment les unes des autres, et que chaque maladie a connu une baisse soudaine et brutale peu de temps après la généralisation du vaccin (exemple : introduction des vaccin antirougeoleux et antipolio) [voir figure].
Enfin, certains remettent en question la validité de la recherche financée par les sociétés pharmaceutiques, résultats qui façonnent à la fois la politique et la pratique de chaque médecin ; chose qu’on ne peut contester !54
Conclusion
Bien qu’ils aient des points de vue opposés sur les vaccins, les pros et anti-vaccins estiment qu’ils font ce qu’il y a de mieux pour leurs enfants. Alors, comment sont-ils parvenus à des conclusions si différentes ? Les attitudes semblent être influencées par l’interprétation statistique, par des facteurs psychologiques inconscients, l’exposition à des récits de vaccins ainsi que l’expérience personnelle. La vaccination a prouvé indéniablement son efficacité historique, toutefois la science aura toujours besoin de sceptiques, de postmodernistes, de théoriciens du complot car ils poussent la communauté scientifique à plus de rigueur et de transparence sur l’utilité et l’innocuité de chaque vaccin, tout en l’immunisant contre les tentations corrosives des profits, pour cristalliser l’axiome central de l’éthique médicale primum non nocere.
Références
1- Friedman, S. (2018). Vaccine Debate. ABC-CLIO, LLC.
2- Chatterjee, A. (2015). Vaccinophobia and vaccine controversies of the 21st century. New York: Springer.
3- Barlow & al. The risk of seizures after receipt of whole-cell pertussis or measles, mumps, and rubella vaccine. N Engl J Med. 2001;345:656–661.
4- Jan E Drutz (2019). Measles, mumps, and rubella immunization in infants, children, and adolescents. Mary M Torchia (Ed.), UpToDate. Retrieved September 20, 2019.
5- Bennett, J. E., Dolin, R., & Blaser, M. J. (2015). Mandell, Douglas, and Bennetts principles and practice of infectious diseases. Philadelphia: Saunders.
6- Watanabe M, Nagai M. Acellular pertussis vaccines in Japan: past, present and future. Expert Rev Vaccines. 2005;4:173–184.
7- Moore & al. Lack of evidence of encephalopathy related to pertussis vaccine: active surveillance by IMPACT, Canada 1993–2002. Pediatr Infect Dis J. 2004;23:568–71.
8- John J Millichap (2019). Clinical features and evaluation of febrile seizures. John F Dashe (Ed.), UpToDate. Retrieved September 20, 2019.
9- Mamishi S. & al. (2016) Aseptic meningitis after measles–mumps–rubella (MMR) vaccination, British Journal of Biomedical Science, 73:2, 84-86.
10- Demicheli V. & al. Vaccines for measles, mumps, and rubella in children. Cochrane Database Syst Rev. 2012;15(2):CD004407.
11- Vellozzi C. & al. Guillain-Barre syndrome, influenza, and influenza vaccination: the epidemiologic evidence. Clin Infect Dis. 2014;58(8):1149–55. 10.1093/cid/ciu005
12- Martín Arias LH & al. Guillain–Barré syndrome and influenza vaccines: A meta-analysis. Vaccine (2015), 2015.05.013
13- Haber P. & al. (2009). Vaccines and Guillain-Barré Syndrome. Drug Safety, 32, 309–323.
14- Wakefield AJ. & al. Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. Lancet (1998) 351:637–41.
15- Kawashima & al. (2000). Detection and sequencing of measles virus from peripheral mononuclear cells from patients with inflammatory bowel disease and autism. Dig. Dis. Sci. 45:723-729.
16- D’Souza, J., & Todd, T. (2003). Measles-mumps-rubella vaccine and the development of autism or inflammatory bowel disease: the controversy should end. The journal of pediatric pharmacology and therapeutics : JPPT : the official journal of PPAG, 8(3), 187–199.
17- Jan E Drutz (2019). Autism spectrum disorder and chronic disease: No evidence for vaccines or thimerosal as a contributing factor. Mary M Torchia (Ed.), UpToDate. Retrieved September 20, 2019.
18- D’Souza Y & al. No evidence of persisting measles virus in peripheral blood mononuclear cells from children with autism spectrum disorder. Pediatrics. 2006;118:1664–1675.
19- Afzal M.A. & al. Absence of detectable measles virus genome sequence in blood of autistic children who have had their MMR vaccination during the routine childhood immunization schedule of UK. J Med Virol. 2006;78:623–630.
20- Stratton, K. R., Gable, A., & McCormick, M. C. (2001). Immunization safety review thimerosal-containing vaccines and neurodevelopmental disorders. Washington, D.C.: National Academy Press.
21- Parker, W. & al. (2017). The role of oxidative stress, inflammation and acetaminophen exposure from birth to early childhood in the induction of autism. The Journal of international medical research, 45(2), 407–438.
22- Pichichero M.E. & al. (2009). Mercury Levels in Premature and Low Birth Weight Newborn Infants after Receipt of Thimerosal-Containing Vaccines. The Journal of Pediatrics, Volume 155, Issue 4, 495 – 499.e2.
23- Hurley, A. M. & al. (2010). Thimerosal-containing vaccines and autism: a review of recent epidemiologic studies. The journal of pediatric pharmacology and therapeutics : JPPT : the official journal of PPAG, 15(3), 173–181.
24- Geier, D. A. & al. (2014). A dose-response relationship between organic mercury exposure from thimerosal-containing vaccines and neurodevelopmental disorders. International journal of environmental research and public health, 11(9), 9156–9170.
25- Geier DA & al. Increased risk for an atypical autism diagnosis following thimerosal-containing vaccine exposure in the United States: a prospective longitudinal case-control study in the vaccine safety datalink. J Trace Elem Med Biol. 2017;42:18–24.
26- Geier DA & al. (2018). A Cross-Sectional Study of the Association between Infant Hepatitis B Vaccine Exposure in Boys and the Risk of Adverse Effects as Measured by Receipt of Special Education Services. International journal of environmental research and public health, 15(1), 123.
27- Geier D.A & al. (2015). Thimerosal exposure and increased risk for diagnosed tic disorder in the United States: a case-control study. Interdisciplinary toxicology, 8(2), 68–76.
28- John M Kelso (2019). Allergic reactions to vaccines. Anna M Feldweg (Ed.), UpToDate. Retrieved September 20, 2019.
29- Morris, G. & al. (2017). The putative role of environmental aluminium in the development of chronic neuropathology in adults and children. How strong is the evidence and what could be the mechanisms involved?. Metabolic brain disease, 32(5), 1335–1355.
30- Rondeau V. & al. Aluminum and silica in drinking water and the risk of Alzheimer’s disease or cognitive decline: Findings from 15-year follow-up of the PAQUID cohort. Am. J. Epidemiol. 2009;169:489–496.
31- Agency for Toxic Substances and Disease Registry (ATSDR). 2008. Toxicological profile for Aluminum. Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service.
32- Verdier F. & al. Aluminium assay and evaluation of the local reaction at several time points after intramuscular administration of aluminium containing vaccines in the Cynomolgus monkey. Vaccine. 2005;23:1359–1367.
33- Dreskin, SC. & al. (2016). International Consensus (ICON): allergic reactions to vaccines. The World Allergy Organization journal, 9(1), 32.
34- Willhite, CC. & al. (2014). Systematic review of potential health risks posed by pharmaceutical, occupational and consumer exposures to metallic and nanoscale aluminum, aluminum oxides, aluminum hydroxide and its soluble salts. Critical reviews in toxicology, 44 Suppl 4(Suppl 4), 1–80.
35- Gherardi R.K. & al. Biopersistence and brain translocation of aluminum adjuvants of vaccines. Front. Neurol. 2015;6:4.
36- Gherardi R.K. & al. (2014). Biopersistence and systemic distribution of intramuscularly injected particles: What impact on long-term tolerability of alum adjuvants?. Bulletin de l’Académie nationale de médecine. 198. 37-48; discussion 49.
37- Gherardi R.K. & al. (2016). Aluminum adjuvants of vaccines injected into the muscle: Normal fate, pathology and associated disease. Morphologie 100: 85–94.
38- Gherardi R.K & al. (2019). Myalgia and chronic fatigue syndrome following immunization: macrophagic myofasciitis and animal studies support linkage to aluminum adjuvant persistency and diffusion in the immune system. Autoimmunity Reviews. 10.1016/j.autrev.2019.05.006.
39- Fritsche P.J. & al. (2010). Vaccine hypersensitivity – update and overview. Swiss Medical Weekly, 140(17-18):238-46.
40- Farooqi I.S., & Hopkin J.M. (1998). Early childhood infection and atopic disorder. Thorax, 53(11), 927–932.
41- Odent MR. & al. Pertussis Vaccination and Asthma: Is There a Link? JAMA. 1994;272(8):592–593.
42- Mrozek-Budzyn D. & al. (2018). Whole-cell pertussis vaccine (DTwP) has no influence on allergic diseases and atopic sensitization in children. Postepy dermatologii i alergologii, 35(4), 381–386.
43- Balicer RD, Grotto I, Mimouni M, Mimouni D. Is childhood vaccination associated with asthma? A meta-analysis of observational studies. Pediatrics 2007;120:e1269–77.
44- Manuel Sánchez-Solis & Luis García-Marcos. (2006). Do vaccines modify the prevalence of asthma and allergies?, Expert Review of Vaccines, 5:5, 631-640.
45- McNeil, Michael M. et al. (2018). Vaccine-associated hypersensitivity. Journal of Allergy and Clinical Immunology, Volume 141, Issue 2, 463 – 472.
46- Timmermann & al. Asthma and allergy in children with and without prior measles, mumps, and rubella vaccination. Pediatr Allergy Immunol 2015: 26: 742– 749.
47- Vasileiou E & al. Effectiveness of influenza vaccines in asthma: a systematic review and meta-analysis. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. 2017;65:1388–1395.
48- Song BJ, Katial RK. Update on side effects from common vaccines. Curr Allergy Asthma Rep. 2004;4:447–53.
49- Swenberg JA & al. Formaldehyde carcinogenicity research: 30 years and counting for mode of action, epidemiology, and cancer risk assessment. Toxicol Pathol. 2013;41(2):181–189.
50- Vilchez RA, Butel JS. Emergent human pathogen simian virus 40 and its role in cancer. Clin Microbiol Rev (2004) 17(3):495–508.
51- Poulin DL, DeCaprio JA. 2006. Is there a role for SV40 in human cancer? J. Clin. Oncol. 24, 4356–4365.
52- Strickler HD & al. Contamination of Poliovirus Vaccines With Simian Virus 40 (1955-1963) and Subsequent Cancer Rates. JAMA. 1998;279(4):292–295.
53- Dang-Tan T & al. Polio vaccines, simian virus 40, and human cancer: the epidemiologic evidence for a causal association. Oncogene. 2004;23(38):6535–6540.
54- Gullion J.S. (2008), Deciding to Opt Out of Childhood Vaccination Mandates. Public Health Nursing, 25: 401-408.
55- Perez-Vilar S. & al. Enhancing global vaccine pharmacovigilance: Proof-of-Concept study on aseptic meningitis and immune thrombocytopenic purpura following measles-mumps containing vaccination. Vaccine. 2018;36:347–354.
56- Stratton, K. R. (2001). Immunization safety review: measles-mumps-rubella vaccine and autism. Washington, D.C.: National Academy Press.

